Apa perbedaan antara model Bohr dan Schrodinger
Itu Perbedaan utama antara model Bohr dan Schrodinger adalah bahwa dalam model Bohr, elektron adalah partikel yang hanya menempati orbit energi tetap tertentu di sekitar nukleus, sedangkan, dalam model Schrodinger, elektron berperilaku sebagai gelombang berdiri yang memiliki probabilitas yang lebih besar berada di beberapa area ruang dibandingkan dengan yang lain.
Model Bohr dan model Schrodinger adalah model yang sangat penting dalam kimia karena mereka menggambarkan struktur kimia atom dan lokasi elektron pada waktu tertentu.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu model bohr
3. Apa itu model schrodinger
4. Model bohr vs schrodinger dalam bentuk tabel
5. Ringkasan -Model Bohr vs Schrodinger
Apa itu model bohr?
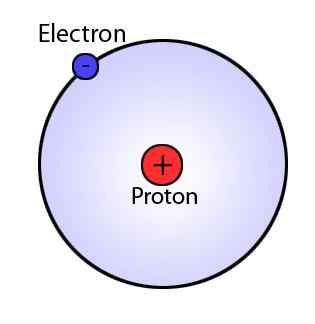
Model Bohr, yang merupakan modifikasi dari model Rutherford, menjelaskan struktur atom yang terdiri dari inti yang dikelilingi oleh elektron. Namun, model Bohr sangat maju dari model Rutherford karena menunjukkan bahwa elektron selalu bepergian dengan cangkang atau orbit tertentu di sekitar nukleus. Model ini juga menyatakan bahwa cangkang ini memiliki energi yang berbeda dan berbentuk bulat. Fenomena ini disarankan dengan pengamatan spektrum garis untuk atom hidrogen.
Karena ada garis diskrit dalam spektrum garis, Bohr menyatakan bahwa orbital atom memiliki energi tetap, dan elektron dapat melompat dari satu tingkat energi ke energi yang memancarkan atau menyerap lainnya, menghasilkan garis dalam spektrum garis pada garis garis garis garis di garis garis di garis garis garis garis garis garis.

Gambar 01: Model Bohr
Deposulat utama model Bohr
- Elektron bergerak di sekitar nukleus dalam orbital bola, yang memiliki ukuran dan energi tetap.
- Setiap orbit memiliki jari -jari yang berbeda dan dinamai dari nukleus ke luar sebagai n = 1, 2, 3, dll., atau n = k, l, m, dll., dimana n adalah nomor tingkat energi tetap.
- Energi orbital terkait dengan ukurannya.
- Orbit terkecil memiliki energi terendah. Atom benar -benar stabil saat elektron berada pada tingkat energi terendah.
- Saat elektron bergerak dalam orbital tertentu, energi elektron itu konstan.
- Elektron dapat berpindah dari satu tingkat energi ke tingkat energi lainnya dengan menyerap atau melepaskan energi.
- Gerakan ini menyebabkan radiasi.
Secara umum, model Bohr sangat cocok dengan atom hidrogen, yang memiliki elektron tunggal dan nukleus kecil bermuatan positif. Selain itu, Bohr menggunakan konstanta papan untuk menghitung energi tingkat energi atom.
Tetapi ada beberapa kelemahan dari model Bohr ketika menjelaskan struktur atom atom selain hidrogen.
Keterbatasan Model Bohr
- Model Bohr tidak dapat menjelaskan efek Zeeman (efek medan magnet pada spektrum atom).
- Itu tidak dapat menjelaskan efek mencolok (efek medan listrik pada spektrum atom).
- Model Bohr gagal menjelaskan spektrum atom atom yang lebih besar.
Apa itu model schrodinger?
Model Schrodinger adalah model dalam kimia yang mengasumsikan bahwa elektron adalah gelombang. Model ini menggambarkan daerah dalam ruang atau orbital sebagai lokasi di mana elektron kemungkinan besar terjadi. Ini adalah model atom yang kuat yang dikembangkan oleh Erwin Schrodinger pada tahun 1926. Dia menggabungkan persamaan untuk perilaku gelombang dan persamaan de broglie untuk membuat model matematika untuk menggambarkan distribusi elektron dalam atom.

Gambar 02: Fungsi gelombang seperti yang dijelaskan oleh Schrodinger
Keuntungan utama dari model Schrodinger adalah bahwa ia mengandung persamaan matematika yang dikenal sebagai fungsi gelombang, yang dapat memenuhi kebutuhan tempat pada perilaku elektron. Namun, mungkin sulit membayangkan model fisik untuk elektron sebagai gelombang. Daripada mencoba mengetahui di mana elektron berada kapan saja, model ini menggambarkan probabilitas elektron yang ditemukan di wilayah ruang tertentu pada waktu tertentu.
Apa perbedaan antara model Bohr dan Schrodinger?
Model Bohr dan model Schrodinger seperti dasar -dasar kimia umum. Perbedaan utama antara model Bohr dan Schrodinger adalah bahwa dalam model Bohr, elektron adalah partikel yang hanya menempati orbit energi tetap tertentu di sekitar nukleus, sedangkan, dalam model Schrodinger, elektron berperilaku sebagai gelombang berdiri yang memiliki probabilitas yang lebih besar untuk berada di beberapa berada di beberapa berada di beberapa orang, area ruang dibandingkan dengan orang lain.
Di bawah ini adalah ringkasan perbedaan antara model Bohr dan Schrodinger dalam bentuk tabel untuk perbandingan berdampingan.
Ringkasan -Model Bohr vs Schrodinger
Baik model Bohr dan model Schrodinger menggambarkan struktur kimia atom dan lokasi elektron pada waktu tertentu. Perbedaan utama antara model Bohr dan Schrodinger adalah bahwa dalam model Bohr, elektron adalah partikel yang hanya menempati orbit energi tetap tertentu di sekitar nukleus, sedangkan, dalam model Schrodinger, elektron berperilaku sebagai gelombang berdiri yang memiliki probabilitas yang lebih besar untuk berada di beberapa berada di beberapa berada di beberapa orang, area ruang dibandingkan dengan orang lain.
Referensi:
1. “Model Schrodinger." Erwin Schrödinger, Pendidikan Purdue.
Gambar milik:
1. "Bohr Model" oleh Jia.Liu - Pekerjaan Sendiri (Domain Publik) Via Commons Wikimedia
2. “WavePacket-A2K4-EN” oleh Xcodexif-Karya Sendiri (CC BY-SA 4.0) Via Commons Wikimedia


