Apa perbedaan antara entalpi dan entalpi molar
Itu Perbedaan utama antara entalpi entalpi dan molar Apakah entalpi adalah kandungan panas total dari sistem termodinamika, sedangkan entalpi molar adalah total panas per mol reaktan dalam sistem.
Entralpi dan entalpi molar adalah istilah yang berguna dalam kimia fisik untuk penentuan kandungan panas total dalam sistem termodinamika. Kita dapat mendefinisikan sistem termodinamika sebagai badan materi atau radiasi yang dibatasi oleh dinding yang memiliki permeabilitas tertentu yang dapat memisahkan sistem ini dari sekitarnya.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa entalpi
3. Apa itu entalpi molar
4. Entalpi dan entalpi molar dalam bentuk tabel
5. Ringkasan - Entralpy vs Molar Enthalpy
Apa entalpi?
Enthalpy dari suatu sistem adalah kuantitas termodinamika yang setara dengan kandungan panas total suatu sistem. Itu sama dengan energi internal sistem ditambah produk tekanan dan volume. Oleh karena itu, ini adalah sifat termodinamika dari suatu sistem.
Persamaan entalpi diberikan di bawah ini.
H = u +pv
Dalam persamaan di atas, h adalah entalpi sistem, U adalah energi internal sistem, p adalah tekanan, dan v adalah volume. Entalpi suatu sistem adalah indikasi kapasitas sistem untuk melepaskan panas (untuk melakukan pekerjaan non-mekanis). Entalpi dilambangkan dengan simbol h.

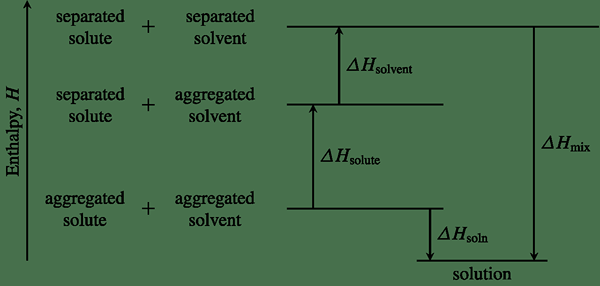
Gambar 01: Diagram entalpi yang menunjukkan perubahan entalpi untuk reaksi kimia tertentu
Menentukan entalpi suatu sistem memungkinkan kita untuk menunjukkan apakah reaksi kimia eksotermik atau endotermik. Perubahan entalpi suatu sistem dapat digunakan untuk menentukan panas reaksi dan untuk memprediksi apakah reaksi kimia spontan atau tidak spontan.
Apa itu entalpi molar?
Entalpi molar adalah nilai entalpi yang diberikan per mol. Dalam definisi ini, entalpi adalah kuantitas termodinamika yang setara dengan kandungan panas total suatu sistem. Itu sama dengan energi internal sistem ditambah produk tekanan dan volume. Unit pengukuran untuk nilai ini adalah kJ/mol. Oleh karena itu, kita dapat memperoleh persamaan untuk penentuan entalpi molar sebagai berikut:
Entalpi molar = dh/n
Di mana DH adalah perubahan entalpi sistem, "n" adalah jumlah mol reaktan yang terlibat dalam sistem. Misalnya, entalpi molar untuk pembentukan zat tertentu adalah perubahan entalpi ketika satu mol spesies kimia terbentuk dalam keadaan standar pada suhu yang ditentukan. Pembentukan zat ini terjadi dari bentuk yang paling stabil dari unsur kimia konstituen dari zat tersebut dalam keadaan standar mereka.
Apa perbedaan antara entalpi dan entalpi molar?
Entralpi dan entalpi molar adalah istilah yang berguna dalam kimia fisik untuk penentuan kandungan panas total dalam sistem termodinamika. Perbedaan utama antara entalpi entalpi dan molar adalah bahwa entalpi adalah kandungan panas total dari sistem termodinamika, sedangkan entalpi molar adalah total panas per mol reaktan dalam sistem. Selain itu, unit pengukuran entalpi adalah joule atau kilojoule, sedangkan unit pengukuran entalpi molar adalah kilojoule per mole.
Tabel berikut merangkum perbedaan antara entalpi dan entalpi molar.
Ringkasan -Entralpy vs Molar Enthalpy
Entralpi dan entalpi molar adalah istilah yang berguna yang membantu menentukan kandungan panas total dalam sistem termodinamika. Enthalpy dari suatu sistem adalah kuantitas termodinamika yang setara dengan kandungan panas total suatu sistem. Entalpi molar adalah nilai entalpi yang diberikan per mol. Oleh karena itu, perbedaan utama antara entalpi entalpi dan molar adalah bahwa entalpi adalah kandungan panas total dari sistem termodinamika, sedangkan entalpi molar adalah total panas per mol reaktan dalam sistem.
Referensi:
1. “Molar entalpi." Tinjauan umum | Topik ScienceDirect, .
2. “Apa entalpi? - Definisi, reaksi endotermik & eksotermik.”Byju, 16 November. 2020.
3. “Enthalpy." Libreteks Kimia, Libretexts, 15 Agustus. 2020.
Gambar milik:
1. “Enthalpy-Diagram-Solution-Formation-Exotermic” oleh Dale J. Brugh - Pekerjaan Sendiri (CC BY -SA 4.0) Via Commons Wikimedia


