Apa perbedaan antara hukum pertama dan hukum termodinamika kedua
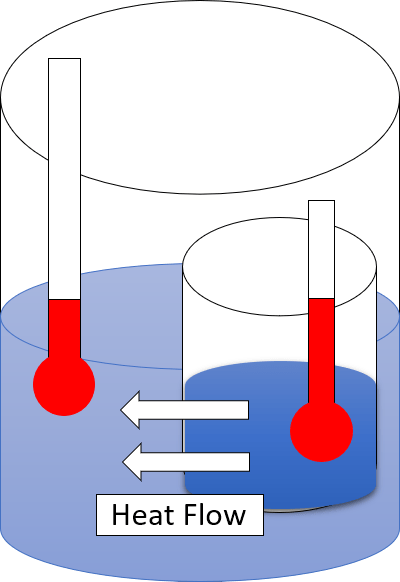
Itu Perbedaan utama antara Hukum Pertama dan Hukum Termodinamika Kedua adalah bahwa hukum termodinamika pertama menyatakan bahwa energi tidak dapat diciptakan atau dihancurkan, dan jumlah total energi di alam semesta tetap sama, sedangkan hukum kedua termodinamika menggambarkan sifat energi.
Termodinamika mengacu pada cabang ilmu fisik yang berhubungan dengan hubungan antara panas dan bentuk energi lainnya seperti energi mekanik, listrik, atau kimia.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa hukum termodinamika pertama
3. Apa hukum kedua termodinamika
4. Hukum Pertama vs Hukum Termodinamika Kedua Dalam Bentuk Tabel
5. Ringkasan -Hukum Pertama vs Hukum Termodinamika Kedua
Apa hukum termodinamika pertama?
Hukum termodinamika pertama menggambarkan bahwa energi internal suatu sistem adalah perbedaan antara energi yang diserap dari lingkungan dan pekerjaan yang dilakukan oleh sistem di sekitarnya. Ini adalah versi hukum konservasi energi yang diadaptasi untuk proses termodinamika. Ini membedakan tiga jenis transfer energi: panas, pekerjaan termodinamika, dan energi internal.
Kita dapat memberikan hukum termodinamika pertama tanpa transfer massal sebagai berikut:
ΔU = q - w
Dalam ungkapan ini, ΔU mengacu pada perubahan energi internal sistem tertutup, sementara Q menunjukkan jumlah energi yang dipasok ke sistem sebagai panas, sedangkan W adalah jumlah pekerjaan termodinamika yang dilakukan oleh sistem di sekitarnya di sekitarnya.

Selain itu, hukum termodinamika pertama dengan kebutuhan transfer massal melibatkan kondisi lebih lanjut; Dengan menjelaskan keadaan referensi yang sesuai dari sistem, ketika dua sistem dipisahkan hanya oleh dinding yang tidak bisa ditembus, mereka digabungkan menjadi sistem baru dengan operasi termodinamika penghapusan dinding ini, yang mengarah ke ekspresi berikut:
U0 = u1 + u2
Di mana U0 adalah energi internal dari sistem gabungan, U1 dan U2 adalah energi internal dari sistem yang sesuai.
Apa hukum kedua termodinamika?
Hukum termodinamika kedua menggambarkan bahwa panas tidak dapat mengalir dari lokasi yang lebih dingin ke area yang lebih panas secara spontan. Ini adalah hukum fisik termodinamika yang menggambarkan panas dan kehilangan dalam konversi. Cara paling sederhana untuk mengekspresikan hukum termodinamika kedua adalah “tidak semua energi panas dapat dikonversi menjadi pekerjaan."
Menurut versi lain dari undang -undang ini, konsep entropi ditetapkan sebagai sifat fisik dari sistem termodinamika. Kita dapat merumuskan hukum kedua termodinamika melalui pengamatan “entropi sistem terisolasi yang tersisa untuk evolusi spontan tidak dapat berkurang karena mereka selalu sampai pada keadaan keseimbangan termodinamika (ini terjadi di mana entropi tertinggi pada energi internal yang diberikan).
Apa perbedaan antara hukum pertama dan hukum termodinamika kedua?
Termodinamika mengacu pada cabang ilmu fisik yang berhubungan dengan hubungan antara panas dan bentuk energi lainnya seperti energi mekanik, listrik, atau kimia. Perbedaan utama antara hukum pertama dan hukum kedua termodinamika adalah bahwa hukum termodinamika pertama menyatakan bahwa energi tidak dapat diciptakan atau dihancurkan dan jumlah total energi di alam semesta tetap sama, sedangkan hukum kedua termodinamika menggambarkan bahwa itu. Panas tidak bisa mengalir dari lokasi yang lebih dingin ke area yang lebih panas secara spontan.
Infografis di bawah ini menyajikan perbedaan antara hukum pertama dan hukum kedua termodinamika dalam bentuk tabel untuk perbandingan berdampingan.
Ringkasan -Hukum Pertama vs Hukum Termodinamika Kedua
Hukum termodinamika pertama menggambarkan bahwa energi internal suatu sistem adalah perbedaan antara energi yang diserap dari lingkungan dan pekerjaan yang dilakukan oleh sistem di sekitarnya. Hukum termodinamika kedua menggambarkan bahwa panas tidak dapat mengalir dari lokasi yang lebih dingin ke area yang lebih panas secara spontan. Jadi, ini adalah perbedaan utama antara hukum pertama dan hukum termodinamika kedua.
Referensi:
1. “Hukum Termodinamika Kedua." NASA.
Gambar milik:
1. "HEAT ALLIGH HOT TO Cold" oleh Blyumj - karya sendiri (CC BY -SA 4.0) Via Commons Wikimedia


