Apa perbedaan antara panas larutan dan panas reaksi
Itu Perbedaan utama antara panas larutan dan panas reaksi adalah bahwa panas larutan adalah jumlah energi panas yang dilepaskan atau diserap oleh sistem kimia setelah pembentukan larutan, sedangkan panas reaksi adalah perbedaan antara reaktan total dan entalpi molar total produk yang dihitung untuk zat kimia dalam keadaan standar.
Panas larutan dan panas reaksi adalah nilai entalpi penting dalam kimia fisik yang berguna dalam penentuan sifat larutan dan reaksi kimia.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu panas larutan
3. Apa panas reaksi
4. Panas larutan vs panas reaksi dalam bentuk tabel
5. Ringkasan -panas larutan vs panas reaksi
Apa itu panas larutan?
Panas larutan atau entalpi larutan adalah jumlah energi panas yang dilepaskan atau diserap oleh sistem kimia setelah pembentukan larutan. Nilai entalpi ini terkait dengan pembubaran zat dalam pelarut yang berada dalam tekanan konstan, yang menghasilkan pengenceran yang tak terbatas.
Paling sering, panas larutan diberikan untuk suhu konstan dalam kJ/mol. Ada tiga bagian dari perubahan energi ini: kehancuran endotermik ikatan kimia yang ada dalam pelarut, memecah ikatan kimia dalam zat terlarut, dan pembentukan gaya tarik antara zat terlarut dan pelarut. Selain itu, kita dapat mengatakan bahwa solusi ideal biasanya mengandung entalpi pencampuran nol sementara solusi yang tidak ideal memiliki jumlah molar berlebih.
Saat mempertimbangkan sebagian besar gas, pembubaran itu eksotermik. Saat gas larut dalam cairan, energi dilepaskan sebagai panas dengan menghangatkan larutan dan lingkungan sekitar. Suhu larutan cenderung berkurang pada akhirnya, sesuai dengan suhu di sekitarnya. Lebih lanjut, jika kita memanaskan larutan gas jenuh, gas cenderung keluar dari larutan.
Apa panas reaksi?
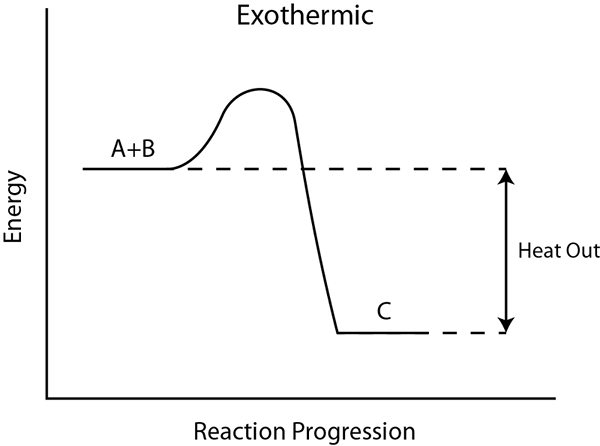
Panas reaksi atau entalpi reaksi adalah perbedaan antara reaktan total dan entalpi molar total produk yang dihitung untuk zat kimia dalam keadaan standar. Nilai entalpi ini berguna dalam memprediksi energi ikatan kimia total yang dilepaskan atau terikat selama reaksi kimia. Di sini, kita perlu memperhitungkan entalpi pencampuran juga.
Dalam penentuan panas reaksi, keadaan standar dapat didefinisikan untuk setiap suhu dan nilai tekanan, dan nilainya harus ditentukan untuk suhu dan tekanan tertentu, tetapi nilainya biasanya diberikan pada suhu Celcius derajat dan 1 tekanan atm.

Saat mempertimbangkan ion dalam larutan berair, kita dapat memilih keadaan standar, mengingat bahwa konsentrasi ion H+ berair tepat 1 mol/L memiliki entalpi pembentukan standar nol standar. Ini memungkinkan untuk menabulasi entalpi standar untuk kation dan anion pada konsentrasi standar yang sama.
Apa perbedaan antara panas larutan dan panas reaksi?
Panas larutan dan panas reaksi adalah nilai entalpi penting dalam kimia fisik yang berguna dalam penentuan sifat larutan dan reaksi kimia. Perbedaan utama antara panas larutan dan panas reaksi adalah bahwa panas larutan adalah jumlah energi panas yang dilepaskan atau diserap oleh sistem kimia setelah pembentukan larutan, sedangkan panas reaksi adalah perbedaan antara reaktan total dan total entalpi molar produk produk produk yang dihitung untuk zat kimia dalam keadaan standar.
Infografis di bawah ini mencantumkan perbedaan antara panas larutan dan panas reaksi dalam bentuk tabel untuk perbandingan berdampingan.
Ringkasan -panas larutan vs panas reaksi
Panas larutan dan panas reaksi adalah nilai entalpi penting dalam kimia fisik yang berguna dalam penentuan sifat larutan dan reaksi kimia. Perbedaan utama antara panas larutan dan panas reaksi adalah bahwa panas larutan adalah jumlah energi panas yang dilepaskan atau diserap oleh sistem kimia setelah pembentukan larutan, sedangkan panas reaksi adalah perbedaan antara reaktan total dan total entalpi molar produk produk produk yang dihitung untuk zat kimia dalam keadaan standar.
Referensi:
1. “Panas formula reaksi - Definisi, persamaan dan contoh terpecahkan.”Byju, 15 September. 2020.
Gambar milik:
1. "Reaksi Eksotermik" oleh Brazosport College - karya sendiri (CC BY -SA 3.0) Via Commons Wikimedia


