Apa perbedaan antara homolisis dan heterolisis
Itu Perbedaan utama antara homolisis dan heterolisis adalah bahwa homolisis adalah kerusakan senyawa kimia menjadi dua bagian yang sama secara kimia, sedangkan heterolisis adalah kerusakan senyawa kimia menjadi dua bagian yang berbeda secara kimia.
Kita dapat menggunakan energi disosiasi ikatan senyawa kimia untuk menggambarkan proses homolisis dan heterolisis. Energi disosiasi ikatan adalah ukuran kekuatan ikatan kimia. Ikatan dapat dipisahkan dengan cara homolitik atau heterolitik. Energi disosiasi ikatan didefinisikan sebagai perubahan entalpi standar ketika ikatan kimia dibelah melalui homolisis.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu homolisis
3. Apa itu heterolisis
5. Homolisis vs heterolisis dalam bentuk tabel
6. Ringkasan
Apa itu homolisis?
Homolisis adalah pembelahan ikatan kimia dengan cara yang memberikan dua bagian yang sama secara kimia dari senyawa kimia. Ikatan kimia (ikatan kovalen) berisi dua elektron. Dalam bentuk fisi ini, masing -masing fragmen mendapat satu elektron yang tidak berpasangan. Ketika disosiasi ikatan ini terjadi dalam molekul netral yang memiliki jumlah elektron genap, ia membentuk dua radikal bebas yang sama.

Gambar 01: Mekanisme fisi homolitik umum
Energi disosiasi ikatan homolitik adalah jumlah energi yang dibutuhkan untuk memisahkan ikatan kimia melalui hemolisis. Hemolisis ikatan kimia adalah pembelahan simetris dari dua radikal pembentukan ikatan, bukan dua ion. Di sini, elektron ikatan antara atom dibagi menjadi dua bagian dan diambil oleh dua atom. Misalnya, pembelahan homolitik dari ikatan sigma membentuk dua radikal yang memiliki satu elektron tidak berpasangan per radikal.
Apa itu heterolisis?
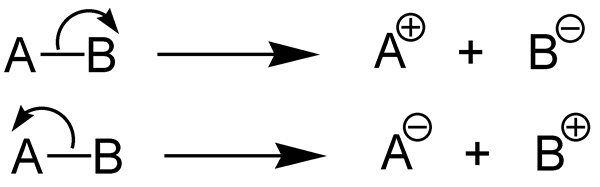
Heterolisis adalah pembelahan ikatan kimia dengan cara yang memberikan dua bagian yang berbeda secara kimia dari senyawa kimia. Fisi heterolitik adalah disosiasi ikatan kimia dan membentuk dua fragmen yang tidak setara. Ikatan kimia (ikatan kovalen) berisi dua elektron. Dalam bentuk fisi ini, satu fragmen mendapatkan kedua pasangan elektron ikatan sementara fragmen lainnya tidak mendapat elektron ikatan.

Gambar 02: Dua jenis fisi heterolitik
Energi Disosiasi Ikatan Heterolitik adalah jumlah energi yang dibutuhkan untuk menutup ikatan kimia melalui heterolisis. Heterolisis adalah pembelahan ikatan kimia secara asimetris. Heterolisis membentuk kation dan anion karena, dalam heterolisis, pasangan elektron ikatan diambil oleh atom elektronegatif (dikonversi menjadi anion), sedangkan atom lainnya tidak mengambil elektron (itu membentuk kation).
Apa perbedaan antara homolisis dan heterolisis?
Homolisis dan heterolisis adalah proses kimia yang saling bertentangan. Perbedaan utama antara homolisis dan heterolisis adalah bahwa homolisis adalah kerusakan senyawa kimia menjadi dua bagian yang sama secara kimia, sedangkan heterolisis adalah kerusakan senyawa kimia menjadi dua bagian yang berbeda secara kimia berbeda secara kimia. Selain itu, energi disosiasi ikatan homolitik menentukan energi yang diperlukan untuk homolisis terjadi sedangkan energi disosiasi ikatan heterolitik menentukan energi yang diperlukan untuk heterolisis terjadi.
Infografis berikut merangkum perbedaan antara homolisis dan heterolisis dalam bentuk tabel.
Ringkasan -Homolisis vs Heterolisis
Homolisis dan heterolisis adalah proses kimia yang saling bertentangan. Perbedaan utama antara homolisis dan heterolisis adalah bahwa homolisis adalah kerusakan senyawa kimia menjadi dua bagian yang sama secara kimia, sedangkan heterolisis adalah kerusakan senyawa kimia menjadi dua bagian yang berbeda secara kimia berbeda secara kimia.
Referensi:
1.“Homolisis." Tinjauan umum | Topik ScienceDirect.
Gambar milik:
1. “Homolisis (Kimia)” oleh Jürgen Martens - Jürgen Martens (domain publik) melalui Commons Wikimedia
2. "Heterolisis (Kimia)" oleh Jürgen Martens - Jürgen Martens (CC BY -SA 3.0) Via Commons Wikimedia


