Apa perbedaan antara penghambatan non-kompetitif dan alosterik
Itu perbedaan utama Antara penghambatan non-kompetitif dan alosterik adalah bahwa dalam penghambatan non-kompetitif, laju maksimum reaksi yang dikatalisis (Vmax) berkurang dan konsentrasi substrat (km) tetap tidak berubah, sedangkan dalam penghambatan alosterik, Vmax tetap tidak berubah dan km meningkat.
Enzim sangat penting untuk sebagian besar reaksi yang terjadi pada organisme. Biasanya, enzim mengkatalisasi reaksi dengan mengurangi energi aktivasi yang diperlukan untuk reaksi. Tetapi enzim harus diatur dengan hati -hati untuk mengendalikan tingkat produk akhir yang naik ke tingkat yang tidak diinginkan. Itu dikendalikan oleh penghambatan enzim. Penghambat enzim adalah molekul yang mengganggu jalur reaksi normal antara enzim dan substrat.
Situs aktif adalah wilayah enzim tempat substrat mengikat dan menjalani reaksi kimia. Situs alosterik adalah di mana ia memungkinkan molekul untuk mengaktifkan atau menghambat aktivitas enzim. Kinetika enzim memainkan peran penting selama penghambatan enzim. Laju maksimum karakteristik reaksi enzim tertentu pada konsentrasi tertentu dikenal sebagai kecepatan maksimum atau vmax. Konsentrasi substrat yang memberikan laju setengah dari vmax adalah km.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa penghambatan non-kompetitif
3. Apa itu penghambatan alosterik
4. Kesamaan - penghambatan non -kompetitif dan alosterik
5. Penghambatan alosterik vs non-kompetitif dalam bentuk tabel
6. Ringkasan - penghambatan alosterik vs non -kompetitif
Apa penghambatan non-kompetitif?
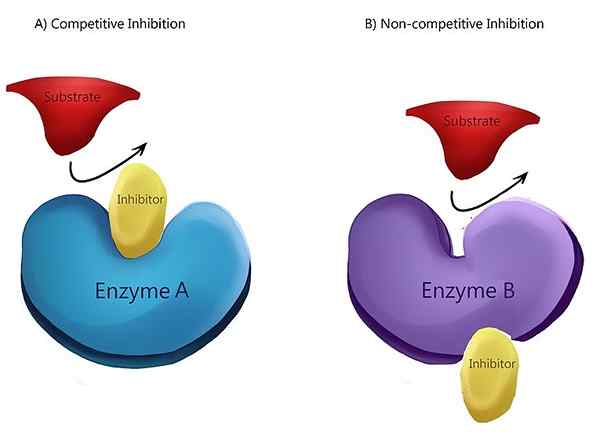
Penghambatan non-kompetitif adalah jenis penghambatan enzim di mana inhibitor mengurangi aktivitas enzim dan mengikat sama baiknya dengan enzim, apakah itu terikat pada substrat atau tidak. Dengan kata lain, penghambatan non-kompetitif adalah di mana inhibitor dan substrat keduanya mengikat enzim pada waktu tertentu. Saat substrat dan inhibitor mengikat dengan enzim, ia membentuk kompleks enzim-substrat-inhibitor. Setelah kompleks ini terbentuk, ia tidak dapat menghasilkan produk apa pun. Itu hanya dapat dikonversi kembali ke kompleks enzim-substrat atau kompleks enzim inhibitor.

Gambar 01: Penghambatan non-kompetitif
Dalam penghambatan non-kompetitif, inhibitor memiliki afinitas yang sama untuk kompleks enzim dan enzim-substrat. Mekanisme paling umum dari inhibitor non-kompetitif adalah pengikatan inhibitor yang dapat dibalik ke situs alosterik. Tetapi inhibitor juga memiliki kemampuan untuk mengikat langsung ke situs aktif. Contoh inhibitor non-kompetitif adalah konversi piruvat kinase menjadi piruvat. Konversi fosfoenolpyruvat untuk menghasilkan piruvat dikatalisis oleh piruvat kinase. Asam amino yang disebut alanin, yang disintesis dari piruvat, menghambat enzim piruvat kinase selama glikolisis. Alanine bertindak sebagai inhibitor yang tidak kompetitif.
Apa itu penghambatan alosterik?
Penghambatan alosterik adalah jenis penghambatan enzim di mana inhibitor memperlambat aktivitas enzim dengan menonaktifkan enzim dan mengikat enzim di situs alosterik. Di sini, inhibitor tidak secara langsung bersaing dengan substrat di situs aktif. Tapi, secara tidak langsung mengubah komposisi enzim. Setelah bentuk berubah, enzim menjadi tidak aktif. Dengan demikian, ia tidak dapat lagi mengikat dengan substrat yang sesuai. Ini, pada gilirannya, memperlambat pembentukan produk akhir.
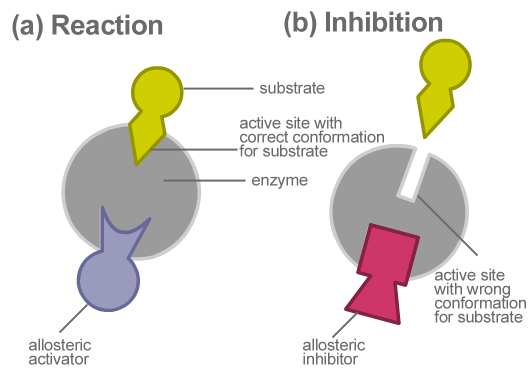
Gambar 02: Penghambatan Alosterik
Penghambatan alosterik mencegah pembentukan produk yang tidak perlu, mengurangi pemborosan energi. Contoh penghambatan alosterik adalah konversi ADP ke ATP dalam glikolisis. Di sini, ketika ada kelebihan ATP dalam sistem, ATP berfungsi sebagai penghambat alosterik. Ini berikatan dengan fosfofruktokinase, yang merupakan salah satu enzim yang terlibat dalam glikolisis. Ini memperlambat konversi ADP. Akibatnya, ATP mencegah produksi yang tidak perlu dari dirinya sendiri. Oleh karena itu, kelebihan produksi ATP tidak diperlukan ketika ada jumlah yang memadai.
Apa kesamaan antara penghambatan non-kompetitif dan alosterik?
- Kedua jenis penghambatan enzim memperlambat aktivitas enzim.
- Inhibitor di kedua penghambatan enzim tidak bersaing dengan substrat di situs aktif.
- Inhibitor mengubah komposisi enzim secara tidak langsung.
- Kedua inhibitor mengubah bentuk enzim.
Apa perbedaan antara penghambatan non-kompetitif dan alosterik?
Dalam penghambatan non-kompetitif, vmax dari reaksi berkurang saat meninggalkan nilai km tidak berubah. Sebaliknya, dalam penghambatan alosterik, Vmax tetap tidak berubah, dan nilai KM meningkat. Jadi, ini adalah perbedaan utama antara penghambatan non-kompetitif dan alosterik. Penghambatan alosterik lebih berfokus pada penggunaan bahan kimia yang mengubah aktivitas enzim dengan mengikat di situs alosterik, sedangkan inhibitor non-kompetitif selalu menghentikan enzim yang berfungsi dengan mengikat secara langsung di situs alternatif alternatif.
Infografis berikut menabulasi perbedaan antara penghambatan non-kompetitif dan alosterik untuk perbandingan berdampingan.
Ringkasan -penghambatan alosterik vs non -kompetitif
Penghambatan non-kompetitif adalah penghambatan enzim di mana inhibitor mengurangi aktivitas enzim dan mengikat sama baiknya dengan enzim apakah terikat pada substrat atau tidak. Penghambatan alosterik adalah jenis penghambatan enzim di mana inhibitor memperlambat aktivitas enzim dengan menonaktifkan enzim dan berikatan dengan enzim di situs alosterik. Perbedaan utama antara penghambatan non-kompetitif dan alosterik adalah bahwa laju maksimum reaksi yang dikatalisis (Vmax) berkurang, dan konsentrasi substrat (km) tetap tidak berubah dalam penghambatan yang tidak kompetitif sementara Vmax tetap tidak berubah, dan KM meningkat dalam alosterik inhibisi.
Referensi:
1. “Regulasi Alosterik: Protokol.”Jove.
2. “Enzim.”Mikrobiologi Tanpa Batas.
Gambar milik:
1. “Penghambatan Enzim Kompetitif & Nonkompetitif” oleh California16 - Karya Sendiri (CC BY -SA 4.0) Via Commons Wikimedia
2. “Penghambatan Allosterik” oleh [[: en: User: 1 | 1]] di wikipedia berbahasa Inggris (CC by-sa 3.0) Via Commons Wikimedia


