Apa perbedaan antara allosterisme positif dan negatif
Itu Perbedaan utama antara allosterisme positif dan negatif adalah bahwa allosterisme positif dalam protein menunjukkan afinitas tinggi terhadap ligan, sedangkan allosterisme negatif dalam protein menunjukkan afinitas rendah terhadap ligan.
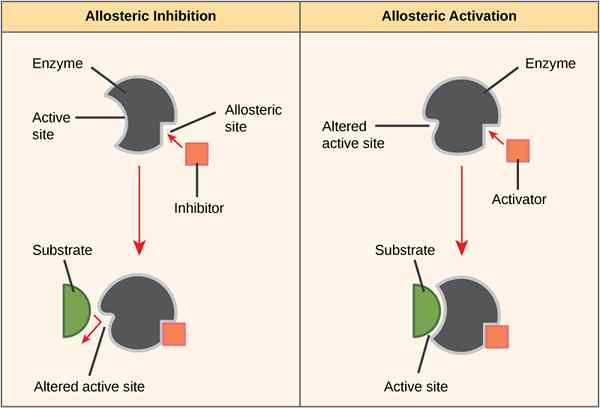
Alosterisme atau perilaku alosterik adalah fenomena di mana aktivitas protein dapat diubah tergantung pada pengikatan beberapa molekul di situs selain situs aktif protein (khususnya dalam enzim). Alosterisme positif menunjukkan bahwa pengikatan molekul efektor ke enzim menyebabkan enzim mengubah konfigurasinya menjadi bentuk aktif. Sebaliknya, allosteirsm negatif menunjukkan bahwa pengikatan molekul efektor menyebabkan enzim mengubah konfigurasinya dari bentuk aktif menjadi bentuk yang tidak aktif.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu alosterisme positif
3. Apa itu alosterisme negatif
4. Allosterisme positif vs negatif dalam bentuk tabel
5. Ringkasan -allosterisme positif vs negatif
Apa itu alosterisme positif?
Allosterisme positif adalah perubahan dalam konfigurasi protein (kebanyakan enzim) dari bentuk tidak aktif menjadi bentuk aktif pada pengikatan molekul efektor. Molekul efektor mengikat dengan situs selain situs aktif enzim; itu disebut situs alosterik. Proses ini juga dikenal sebagai aktivasi alosterik.
Contoh umum untuk pengikatan molekul efektor tersebut adalah ikatan molekul oksigen dengan molekul hemoglobin, yang mengaktifkan molekul hemoglobin untuk secara efektif mengangkut oksigen ke sel. Di sana, molekul oksigen mengikat dengan besi besi dari molekul heme dalam molekul hemoglobin. Bentuk aktif dikenal sebagai oxy-hemoglobin, sedangkan bentuk tidak aktif dikenal sebagai deoksi-hemoglobin.
Apa itu alosterisme negatif?
Allosterisme negatif adalah perubahan dalam konfigurasi enzim dari bentuk aktif ke bentuk yang tidak aktif pada pengikatan molekul efektor. Molekul efektor mengikat dengan situs selain situs aktif enzim; itu disebut situs alosterik. Proses ini juga dikenal sebagai penghambatan alosterik.

Gambar 01: Allosterisme positif dan negatif
Selama alosterisme negatif, pengikatan satu ligan mengurangi afinitas enzim untuk substrat di situs aktif lainnya yang tersedia untuk pengikatan substrat. Contohnya adalah pengikatan 2,3-bpg ke situs alosterik pada hemoglobin, yang menyebabkan penurunan afinitas untuk oksigen dari semua subunit.
Apa perbedaan antara allosterisme positif dan negatif?
Dalam alosterisme positif, pengikatan molekul efektor ke enzim menyebabkan enzim mengubah konfigurasinya menjadi bentuk aktif, sementara dalam allosteirsm negatif, pengikatan molekul efektor menyebabkan enzim mengubah konfigurasi dari bentuk aktif ke bentuk yang tidak aktif. Perbedaan utama antara allosterisme positif dan negatif adalah bahwa allosterisme positif dalam protein menunjukkan afinitas tinggi terhadap ligan, sedangkan alosterisme negatif dalam protein menunjukkan afinitas rendah terhadap ligan. Selain itu, allosterisme positif melibatkan aktivasi, sedangkan allosteirsm negatif melibatkan penghambatan. Ikatan oksigen dengan hemoglobin adalah contoh allosterisme positif sambil mengikat 2,3-bpg dengan hemoglobin adalah contoh allosterisme negatif.
Infografis berikut menyajikan perbedaan antara alosterisme positif dan negatif dalam bentuk tabel untuk perbandingan berdampingan.
Ringkasan -allosterisme positif vs negatif
Dalam alosterisme atau perilaku alosterik, aktivitas protein dapat diubah tergantung pada pengikatan beberapa molekul di situs selain situs aktif protein (khususnya dalam enzim). Perbedaan utama antara allosterisme positif dan negatif adalah bahwa allosterisme positif dalam protein menunjukkan afinitas tinggi terhadap ligan, sedangkan alosterisme negatif dalam protein menunjukkan afinitas rendah terhadap ligan.
Referensi:
1. “3.6: Interaksi Alosterik." Libreteks Kimia, Libretexts, 17 Juli 2020.
Gambar milik:
2. “Gambar 06 05 05 - Aktivasi dan Penghambatan Allosterik” oleh CNX OpenStax - (CC oleh 4.0) Via Commons Wikimedia


