Perbedaan antara konstanta ionisasi asam dan konstanta ionisasi basa
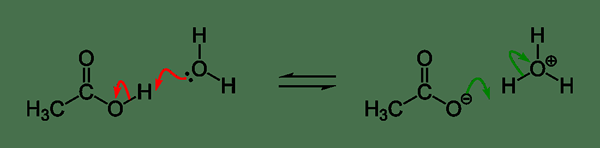
Perbedaan utama - ionisasi asam Konstan vs konstanta ionisasi dasar
Konstanta ionisasi asam (Ka, juga dikenal sebagai konstanta disosiasi asam) memberikan pengukuran kuantitatif keseimbangan yang ada antara molekul asam dan bentuk terionisasi mereka. Demikian pula, konstanta ionisasi dasar (KB, atau konstanta disosiasi dasar) memberikan pengukuran kuantitatif keseimbangan yang ada antara molekul dasar dan bentuk terionisasi mereka. Itu perbedaan utama antara konstanta ionisasi asam dan konstanta ionisasi basa adalah itu Konstanta ionisasi asam memberikan ukuran kuantitatif kekuatan asam dalam suatu larutan sedangkan konstanta ionisasi basa memberikan ukuran kuantitatif kekuatan basa dalam larutan.
Ionisasi adalah pemisahan molekul menjadi spesies ionik (kation dan anion). Konstanta kesetimbangan adalah hubungan antara jumlah reaktan dan produk yang berada dalam keseimbangan satu sama lain.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu ionisasi asam konstan
3. Apa itu konstanta ionisasi dasar
4. Perbandingan Berdampingan - Konstanta Ionisasi Asam Konstanta Ionisasi Basa Konstan dalam Bentuk Tabel
5. Ringkasan
Apa itu ionisasi asam konstan?
Konstanta ionisasi asam adalah jumlah yang mengekspresikan hubungan antara molekul asam dan spesies ionik yang ada dalam larutan yang sama. Konstanta disosiasi asam dilambangkan dengan KA. Ini adalah ukuran kuantitatif kekuatan asam dalam suatu larutan. Kekuatan asam tergantung pada ionisasi (atau disosiasi) asam dalam larutan berair.
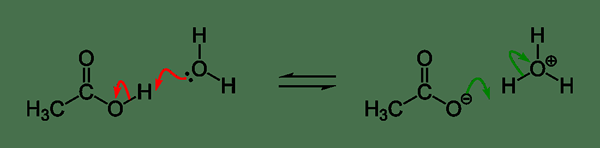
Gambar 01: Contoh untuk ionisasi asam
Ionisasi asam dapat diberikan seperti di bawah ini,
Ha + h2O ↔ a- + H3HAI+
Dalam hal ini, HA adalah asam lemah yang memisahkan sebagian ion; Anion dikenal sebagai basa terkonjugasi dari asam tertentu. Disosiasi asam melepaskan proton (ion hidrogen; H+). Proton ini bergabung dengan molekul air yang membentuk ion hidronium (h3HAI+). Konstanta ionisasi asam dari asam HA ini dapat diberikan seperti di bawah ini,
Ka = [a-][ H3HAI+] / [Ha] [h2HAI]
Bentuk umum kA adalah pKa, yang merupakan nilai log minus dari ka. Itu karena nilai KA adalah nilai yang sangat kecil dan sulit ditangani. PKA memberikan nomor sederhana yang mudah ditangani. Itu bisa diberikan seperti di bawah ini,
pKa = -log (ka)
Nilai KA atau PKA dapat digunakan untuk mengekspresikan kekuatan asam.
- Asam lemah memiliki nilai KA yang lebih rendah dan nilai PKA yang lebih tinggi
- Asam kuat memiliki nilai KA yang lebih tinggi dan nilai PKA yang lebih rendah.
Apa itu konstanta ionisasi dasar?
Konstanta ionisasi dasar adalah angka yang mengekspresikan hubungan antara molekul dasar dan spesies ionik ada dalam larutan yang sama. Ini dilambangkan dengan KB. Ini mengukur kekuatan basis dalam suatu larutan. Lebih tinggi KB, lebih tinggi ionisasi basis. Untuk basis tertentu dalam suatu larutan, konstanta disosiasi dasar dapat diberikan seperti di bawah ini,
B+ H2O ↔ bh+ + OH-
Kb = [bh+][OH-] / [B] [h2HAI]
Karena nilai KB basa adalah nilai yang sangat kecil, nilai log minus KB digunakan sebagai gantinya KB. Nilai log minus KB dilambangkan dengan PKB. PKB memberikan nomor yang mudah ditangani.
pkb = -log (kb)
Kekuatan suatu basis dapat diekspresikan dengan nilai KB atau nilai PKB sebagai berikut.
- Lebih tinggi nilai konstanta ionisasi basa, lebih kuat basis (lebih rendah pkb)
- Turunkan nilai konstanta ionisasi basa, lebih lemah basis (lebih tinggi pkb)
Apa perbedaan antara konstanta ionisasi asam dan konstanta ionisasi basa?
Konstanta ionisasi ionisasi asam vs konstanta ionisasi basa | |
| Konstanta ionisasi asam adalah jumlah yang mengekspresikan hubungan antara molekul asam dan spesies ionik yang ada dalam larutan yang sama. | Konstanta ionisasi dasar adalah angka yang mengekspresikan hubungan antara molekul dasar dan spesies ionik yang ada dalam larutan yang sama. |
| Konsep | |
| Konstanta ionisasi asam memberikan kekuatan asam. | Konstanta ionisasi dasar memberikan kekuatan dasar. |
| Nilai log | |
| Nilai log minus KA adalah PKA. | Nilai log minus KB adalah PKB. |
| Nilai konstan | |
| Asam lemah memiliki nilai Ka yang lebih rendah dan nilai PKA yang lebih tinggi sedangkan asam kuat memiliki nilai KA yang lebih tinggi dan nilai PKA yang lebih rendah. | Basis yang lemah memiliki nilai KB yang lebih rendah, dan nilai PKB yang lebih tinggi sedangkan basa yang kuat memiliki nilai KB yang lebih tinggi dan nilai PKB yang lebih rendah. |
Ringkasan - Ionisasi asam Konstan vs konstanta ionisasi dasar
Konstanta ionisasi asam dan konstanta ionisasi basa masing -masing adalah ukuran asam dan kekuatan basa. Perbedaan antara konstanta ionisasi asam dan konstanta ionisasi basa adalah bahwa konstanta ionisasi asam memberikan ukuran kuantitatif kekuatan asam dalam suatu larutan sedangkan konstanta ionisasi basa memberikan ukuran kuantitatif dari kekuatan suatu basa dalam larutan suatu larutan.
Referensi:
1.“16.4: Kekuatan asam dan konstanta disosiasi asam (KA).”Kimia Libretexts, Libretexts, 26 Feb. 2017. Tersedia disini
2.“Basis yang kuat dan lemah dan konstanta ionisasi dasar (KB).”CK-12 Foundation, CK-12 Foundation, 11 September. 2016. Tersedia disini
3.“Asam dan basa: konstanta ionisasi.Ionisasi asam dan basa. Tersedia disini
Gambar milik:
1.'Acetic-ACID-DISSOCIATION-2D-Curly-Arrows'By Ben Mills-karya sendiri, (domain publik) melalui Commons Wikimedia


