Perbedaan antara aluminium sulfat dan amonium sulfat

Itu Perbedaan utama antara aluminium sulfat dan amonium sulfat adalah bahwa aluminium sulfat adalah garam logam, sedangkan amonium sulfat adalah garam anorganik.
Aluminium sulfat adalah garam logam yang memiliki formula kimia AL2 (SO4) 3, sedangkan amonium sulfat adalah senyawa anorganik yang memiliki formula kimia (NH4)2JADI4.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu aluminium sulfat
3. Apa itu amonium sulfat
4. Aluminium sulfat vs amonium sulfat dalam bentuk tabel
5. Ringkasan
Apa itu aluminium sulfat?
Aluminium sulfat adalah garam logam yang memiliki formula kimia AL2 (SO4) 3. Zat ini larut dalam air dan berguna terutama sebagai zat koagulan selama pemurnian air minum dan di pabrik pengolahan air limbah. Selain itu, zat ini berguna di industri kertas.

Gambar 01: Penampilan aluminium sulfat
Ada bentuk anhidrat dan bentuk terhidrasi dari aluminium sulfat. Secara alami, bentuk anhidrat dapat diamati dalam mineral langka bernama Millosevichite. Kita dapat menemukan mineral langka ini di situs gunung berapi. Namun, terjadinya bentuk anhidrat sangat jarang. Ada berbagai hidrat aluminium sulfat, yang mencakup bentuk hexadecahydrated sebagai bentuk terhidrasi yang paling umum. Selain itu, aluminium sulfat heptadecahydrate terjadi secara alami dalam mineral alunogen.
Massa molar aluminium sulfat anhidrat adalah 342.15 g/mo. Itu muncul sebagai padatan kristal putih yang sangat higroskopis. Terkadang, zat ini dikenal sebagai tawas, atau sebagai tawas Papermaker sesuai dengan aplikasi yang berbeda.
Di laboratorium, kita dapat menghasilkan aluminium sulfat melalui penambahan aluminium hidroksida ke asam sulfat atau melalui pemanasan logam aluminium dengan adanya asam sulfat. Kami juga dapat menghasilkan zat ini dari sekis tawas yang menggunakan campuran pirit besi, aluminium silikat dan berbagai zat bituminous.
Apa itu amonium sulfat?
Amonium sulfat adalah senyawa anorganik yang memiliki formula kimia (NH4)2JADI4. Zat ini mengandung kation amonium yang terkait dengan anion sulfat. Oleh karena itu, ia memiliki dua kation amonium per anion sulfat. Kita dapat menyebutkan zat ini sebagai garam sulfat anorganik dengan banyak kegunaan penting.
Massa molar amonium sulfat adalah 132.14 g/mol. Senyawa ini muncul sebagai butiran atau kristal higroskopis halus. Selain itu, titik leleh senyawa ini dapat berkisar dari 235 hingga 280 ° C; Di atas kisaran suhu ini, senyawa cenderung terurai. Kami dapat menghasilkan senyawa amonium sulfat dengan mengobati amonia dengan asam sulfat. Untuk persiapan ini, kita dapat menggunakan campuran gas amonia dan uap air dalam reaktor. Selain itu, kita perlu menambahkan asam sulfat pekat ke dalam reaktor ini, dan kemudian reaksi antara komponen ini akan membentuk amonium sulfat.
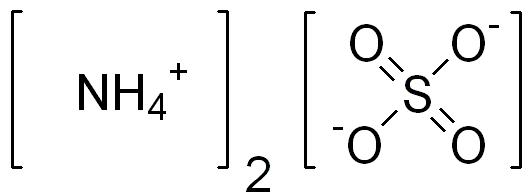
Gambar 02: Struktur kimia amonium sulfat
Saat mempertimbangkan aplikasi amonium sulfat, kita dapat menggunakannya sebagai pupuk, terutama untuk tanah alkali. Selain itu, kita dapat menggunakannya dalam produksi insektisida, herbisida, fungisida, dll. Selain itu, kami menggunakan senyawa ini untuk pemurnian protein melalui presipitasi di laboratorium biokimia. Ini juga berguna sebagai aditif makanan.
Perbedaan antara aluminium sulfat dan amonium sulfat
Aluminium sulfat adalah garam logam yang memiliki formula kimia AL2 (SO4) 3 sedangkan amonium sulfat adalah senyawa anorganik yang memiliki formula kimia (NH4)2JADI4. Perbedaan utama antara aluminium sulfat dan amonium sulfat adalah bahwa aluminium sulfat adalah garam logam, sedangkan amonium sulfat adalah garam anorganik.
Infografis berikut mencantumkan perbedaan antara aluminium sulfat dan amonium sulfat dalam bentuk tabel.
Ringkasan -Aluminium sulfat vs amonium sulfat
Aluminium sulfat adalah garam logam yang memiliki formula kimia AL2 (SO4) 3, sedangkan amonium sulfat adalah senyawa anorganik yang memiliki formula kimia (NH4)2JADI4. Perbedaan utama antara aluminium sulfat dan amonium sulfat adalah bahwa aluminium sulfat adalah garam logam, sedangkan amonium sulfat adalah garam anorganik.
Referensi:
1. “Penggunaan aluminium sulfat." Produsen aluminium.
Gambar milik:
1. Gambar "Aluminium Sulfat" yang diambil oleh Martin Walker pada Juni 2005. (Domain publik) via commons wikimedia
2. "Ammonium Sulfate" oleh Edgar181 - karya sendiri (domain publik) melalui Commons Wikimedia


