Perbedaan antara persamaan seimbang dan persamaan ionik bersih

Perbedaan Utama - Persamaan Balanced vs Persamaan Ionik Net
Semua reaksi kimia dapat ditulis sebagai persamaan. Komponen persamaan ini termasuk reaktan dengan keadaan fisik mereka, panah untuk menunjukkan arah reaksi dan produk reaksi dengan keadaan fisik mereka. Jika ada kondisi khusus yang digunakan, mereka juga ditulis secara singkat di panah. Jika reaksi berada dalam keseimbangan, dua panah setengah digunakan dalam arah yang berlawanan. Persamaan kimia dapat ditulis dengan dua cara: sebagai persamaan seimbang atau sebagai persamaan ionik bersih. Perbedaan utama antara persamaan seimbang dan persamaan ionik bersih adalah bahwa Persamaan yang seimbang menunjukkan semua reaksi yang terjadi dalam suatu sistem bersama sedangkan Persamaan ionik bersih hanya menunjukkan reaksi bersih yang terjadi setelah selesainya reaksi tertentu.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa persamaan yang seimbang
3. Apa persamaan ionik bersih
4. Perbandingan berdampingan - persamaan seimbang vs persamaan ionik bersih
5. Ringkasan
Apa persamaan yang seimbang?
Reaksi kimia sangat penting dalam memahami perilaku sistem tertentu. Dengan menulis persamaan yang benar untuk reaksi, orang bisa mendapatkan ide tentang perubahan spesies yang berbeda dalam sistem itu. Untuk reaksi sederhana seperti melarutkan NaCl dalam air, persamaan dapat ditulis dengan mudah dengan memprediksi produk yang mungkin dari reaksi tersebut. Tetapi untuk reaksi kompleks lainnya, tes lebih lanjut mungkin harus dilakukan untuk mengetahui produk dari sistem tertentu. Tetapi sebagian besar waktu, persamaan tertulis sangat mungkin tidak seimbang, yang membuatnya sulit untuk menjelaskan perilaku kimia sistem itu. Oleh karena itu, persamaan yang tidak seimbang juga harus seimbang. Persamaan yang seimbang mencakup semua reaktan dan produk dari sistem itu. Persamaan ini ditulis dengan mempertimbangkan senyawa reaktan sebagai molekul. Misalnya, persamaan seimbang antara Ki dan PBNO3 (Jika itu bereaksi dalam air) akan terjadi;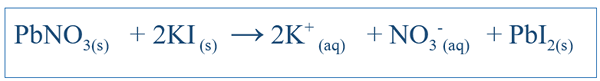
Pentingnya persamaan yang seimbang adalah bahwa ia mengungkapkan jumlah reaktan yang harus ditambahkan memberikan perincian tentang hubungan stoikiometri antara spesies dalam sistem. Dalam contoh di atas, rasio antara PBNO3 dan ki harus 1: 2 saat menambahkan komponen -komponen itu ke dalam sistem.
Apa persamaan ionik bersih?
Persamaan ionik bersih hanya menunjukkan reaksi keseluruhan yang telah terjadi dalam sistem. Itu termasuk spesies ionik dan produk yang dibentuk. Tapi itu tidak menunjukkan semua reaksi yang telah terjadi dalam sistem tertentu. Misalnya, jika ada reaksi antara dua molekul menggunakan air sebagai media, senyawa mungkin telah larut dalam air dan dipisahkan menjadi ion. Beberapa ion ini mungkin terlibat dalam reaksi tetapi beberapa mungkin tidak. Kemudian persamaan ionik bersih hanya mencakup ion yang berpartisipasi dalam reaksi bersih. Ion lain, yang disebut ion penonton, dihilangkan dari persamaan untuk mendapatkan persamaan ionik bersih. Misalnya, jika ki dan pbno3 bereaksi dalam air, reaksi ionik bersih akan terjadi;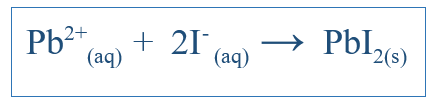
Ini juga harus termasuk k+ ion dan no3- ion, tetapi ion -ion itu hanya akan larut dan tidak mengambil bagian dalam reaksi utama; Dengan demikian, mereka tidak termasuk dalam reaksi ionik bersih.
Apa perbedaan antara persamaan seimbang dan persamaan ionik bersih?
Persamaan seimbang vs persamaan ionik bersih | |
| Semua komponen yang digunakan ditulis sebagai reaktan dalam persamaan yang seimbang. | Reaktan yang hanya terlibat dalam reaksi bersih akan ditulis dalam reaksi ionik bersih. |
| Produk | |
| Semua komponen di akhir reaksi termasuk dalam persamaan yang seimbang. | Dalam persamaan ionik bersih, hanya produk ujung bersih yang ditulis. |
| Detail yang diberikan | |
| Persamaan yang seimbang akan memberikan perincian tentang semua spesies yang ada dalam sistem. | Persamaan ionik bersih hanya memberikan rincian tentang spesies yang mengambil bagian dalam reaksi |
Ringkasan - persamaan seimbang vs persamaan ionik bersih
Ketika senyawa ionik tertentu ditambahkan ke air, mereka pecah dan membentuk ion yang dilarutkan dalam air. Ini menghasilkan anion dan kation. Untuk menunjukkan spesies yang diproduksi setelah selesainya reaksi dan arah reaksi, persamaan kimia dapat ditulis. Persamaan ini dapat diseimbangkan mengingat jumlah atom dari masing -masing spesies yang berada di kedua sisi panah; Terkadang, bahkan muatan spesies tersebut harus dipertimbangkan. Ini memberikan persamaan kimia yang seimbang untuk sistem tertentu. Namun, persamaan ionik bersih hanya mencakup spesies yang bereaksi. Seperti yang ditunjukkan sebelumnya, perbedaan utama antara persamaan yang seimbang dan persamaan ionik bersih adalah bahwa persamaan yang seimbang menunjukkan semua reaksi dalam suatu sistem sedangkan persamaan ionik bersih hanya menunjukkan reaksi bersih yang terjadi pada penyelesaian reaksi tertentu.
Referensi:
1. Chang, r., 2010. kimia. Edisi ke -10. NewYork: McGraw-Hill.
2. Reaksi kimia. (N.D.). Diperoleh 26 Mei 2017, dari http: // www.ric.edu/fakultas/ptiskus/reaksi/
3. Persamaan ionik dan ionik lengkap. (N.D.). Diperoleh 26 Mei 2017, dari https: // www.Khanacademy.org/sains/kimia/reaksi kimia-stoichiome/tipe-reaksi-kimia/A/A/Lengkap-ionik-dan-net-ionik-persamaan.


