Perbedaan antara ligan Bidentate dan Ambidentate
Perbedaan Utama - Bidentate VS Ambidentate Ligan
Itu perbedaan utama Antara ligan Bidentate dan Ambidentate adalah itu Ligan Bidentate dapat berikatan dengan atom pusat melalui dua ikatan pada saat yang sama sedangkan ligan ambiden dapat membentuk dua ikatan dengan atom pusat, tetapi hanya membentuk satu ikatan pada satu waktu.
Ligan adalah molekul atau anion yang kaya elektron yang dapat menyumbangkan pasangan elektron tunggal ke atom yang memiliki muatan listrik yang positif. Ada beberapa jenis ligan yang dinamai ligan monodentate, ligan unggul, ligan polydentate, dll. berdasarkan jumlah obligasi yang dapat mereka bentuk dengan atom.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu ligan Bidentate
3. Apa itu ligan ambisid
4. Kesamaan antara ligan Bidentate dan Ambidentate
5. Perbandingan berdampingan - ligan Bidentate vs Ambidentate dalam bentuk tabel
6. Ringkasan
Apa itu ligan Bidentate?
Ligan Bidentate adalah molekul atau anion yang dapat mengikat atom melalui dua ikatan kovalen koordinat. Koordinat ikatan kovalen adalah jenis ikatan kovalen yang terbentuk ketika spesies kimia yang kaya elektron menyumbangkan pasangan elektron tunggal untuk spesies kimia yang kekurangan elektron seperti atom logam bermuatan positif secara positif. Saat ligan dan kation mengikat dengan cara ini, senyawa koordinasi terbentuk. Atom tempat ligan terikat dengan disebut Pusat Koordinasi.
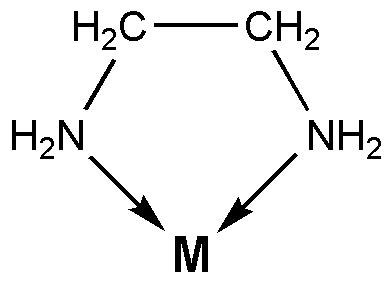
Gambar 01: Ethylenediamine adalah ligan Bidentate
Ligan Bidentate memiliki dua atom donor. Ini berarti, ada dua atom yang dapat menyumbangkan pasangan elektron tunggal mereka. Beberapa contoh umum untuk ligan Bidentate termasuk ion oksalat (c2HAI42-) yang memiliki dua atom oksigen sebagai atom donor dan etilenediamine (C₂H₄ (NH₂) ₂) yang memiliki dua atom nitrogen sebagai atom donor.
Apa itu ligan ambisid?
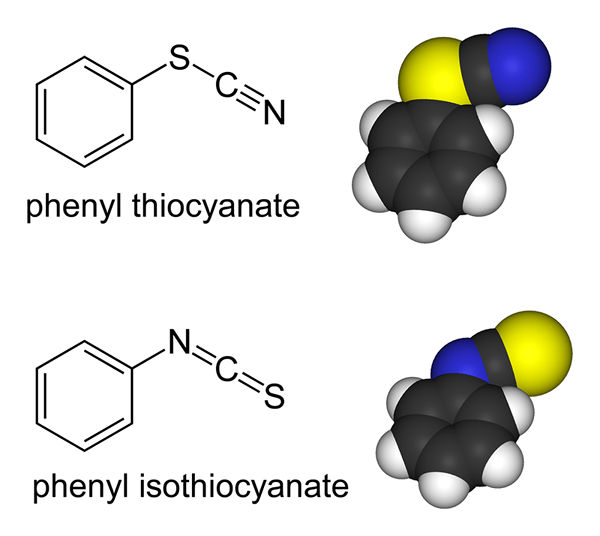
Ligan ambisid adalah molekul atau ion yang memiliki dua atom donor tetapi mampu mengikat dengan atom melalui hanya satu atom donor sekaligus. Contoh Ligan Ambidentat termasuk ion tiosianat (SCN-) di mana atom sulfur dan atom nitrogen mampu menyumbangkan pasangan elektron tunggal. Tetapi atom sulfur atau atom nitrogen dapat mengikat ke pusat koordinasi sekaligus.

Gambar 02: Thiocyanate adalah ligan ambidata
Contoh lain adalah nitrat ion (tidak2-) di mana atom nitrogen dan atom oksigen dapat menjadi atom donor.
Apa kesamaan antara ligan Bidentate dan ambidentat?
- Baik ligan Bidentate dan Ambidentate memiliki dua atom donor.
- Kedua ligan memiliki setidaknya dua atom dengan pasangan elektron tunggal.
Apa perbedaan antara ligan Bidentate dan Ambidentate?
Ligan Bidentate vs Ambidentate | |
| Ligan Bidentate adalah molekul atau anion yang dapat mengikat atom melalui dua ikatan kovalen koordinat. | Ligan ambisid adalah molekul atau ion yang memiliki dua atom donor tetapi mampu mengikat dengan atom melalui hanya satu atom donor sekaligus. |
| Pembentukan ikatan | |
| Ligan Bidentate mampu membentuk dua ikatan kovalen koordinat sekaligus. | Ligan ambisid mampu membentuk satu ikatan kovalen koordinat sekaligus. |
| Contoh | |
| Contoh Ligan Bidentate termasuk ion etilenediamine dan oksalat. | Contoh Ligan Ambidentat termasuk ion thiocyanate dan ion nitrat. |
Ringkasan - Bidentate vs Ambidentate Ligan
Ligan adalah molekul atau ion yang dapat mengikat dengan atom yang kekurangan elektron melalui ikatan kovalen koordinat. Ligan Bidentate dan Ligan Ambidentate adalah dua bentuk ligan seperti itu. Perbedaan antara ligan Bidentate dan Ambidentate adalah bahwa ligan Bidentate dapat berikatan dengan atom pusat melalui dua ikatan pada saat yang sama sedangkan ligan ambiden mampu membentuk dua ikatan dengan atom pusat tetapi hanya membentuk satu ikatan pada satu waktu.
Referensi:
1. “Ligan | Jenis Ligan | Ligan Chelate, Denticity, Ambidentate Ligand | Kimia | BYJU.Kimia, kelas Byjus, 8 Mar. 2018. Tersedia disini
2. Libretexts. “Ligan."Kimia Libretexts, Libretexts, 19 Jan. 2018. Tersedia disini
Gambar milik:
1.'M-en1'by tidak ada penulis yang dapat dibaca mesin yang disediakan (domain publik) melalui commons wikimedia
2.'PHSCN-PHNCS-Comparison' (domain publik) melalui Commons Wikimedia


