Perbedaan antara asam biner dan okyacids

Itu perbedaan utama Antara asam biner dan okyacids adalah bahwa Oxyacids mengandung setidaknya satu atom oksigen dalam molekul, tetapi asam biner tidak mengandung oksigen. Asam biner memiliki hidrogen dan elemen non-logam lainnya dalam molekul.
Kita dapat mendefinisikan asam dalam beberapa cara menurut berbagai ilmuwan. Menurut arrhenius atau definisi lowry bronsted, senyawa harus memiliki atom hidrogen dan harus dapat menyumbangkannya sebagai proton jika kita ingin menyebutnya sebagai asam. Tetapi menurut Lewis, ada molekul, yang tidak memiliki hidrogen, tetapi dapat bertindak sebagai asam, saya.e. Bcl3 adalah asam Lewis, karena dapat menerima pasangan elektron. Terlepas dari jenis di atas, kami dapat menggambarkan dan mengklasifikasikan asam dalam banyak hal lain. Misalnya, sebagai asam anorganik dan organik tergantung pada unsur -unsur yang mereka miliki dan juga sebagai asam biner dan okyacids.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu asam biner
3. Apa itu oxyacids
4. Perbandingan Berdampingan - Asam Biner Vs Oxyacids Dalam Bentuk Tabel
5. Ringkasan
Apa itu asam biner?
Asam biner adalah molekul, yang mengandung dua elemen; Satu elemen adalah hidrogen, dan yang lainnya adalah elemen non -logam, yang lebih elektronegatif daripada hidrogen. Oleh karena itu, asam biner dapat menyumbangkan h+ ion di media berair. Hcl, hf, hbr, dan h2S adalah beberapa contoh untuk asam biner. Ini menunjukkan sifat yang berbeda ketika mereka dalam bentuk murni dan ketika mereka berada di media berair.
Dalam nomenklatur asam biner, jika asam dalam bentuk murni, namanya dimulai dengan "hidrogen", dan nama anionik berakhir dengan "-dide". Misalnya, kita dapat menyebutkan HCl sebagai hidrogen klorida. Nama larutan asam biner berair dimulai dengan "hidro", dan nama anion berakhir dengan "IC". Di sana, kami menambahkan kata "asam" ke akhir nama. Misalnya, larutan HCl berair adalah asam klorida.

Gambar 01: HCL adalah asam biner
Selanjutnya, kita dapat menentukan kekuatan asam biner dengan seberapa mudah menyumbang h+ ke medium. Jika ikatan antara hidrogen dan elemen lainnya lemah, ia dapat dengan mudah menyumbangkan proton; Dengan demikian, asam lebih kuat. Stabilitas anion yang terbentuk juga mempengaruhi kemampuan donasi proton. Misalnya, hai adalah asam yang lebih kuat dari hcl, karena saya- Anion lebih stabil daripada CL- anion.
Apa itu oxyacids?
Oxyacids adalah asam yang mengandung atom oksigen dalam molekul. Hno3, H2JADI4, H2BERSAMA3, H3PO4, Ch3COOH adalah beberapa okyacid umum. Selain oksigen, setidaknya ada satu elemen lain dan setidaknya satu atom hidrogen dalam molekul.
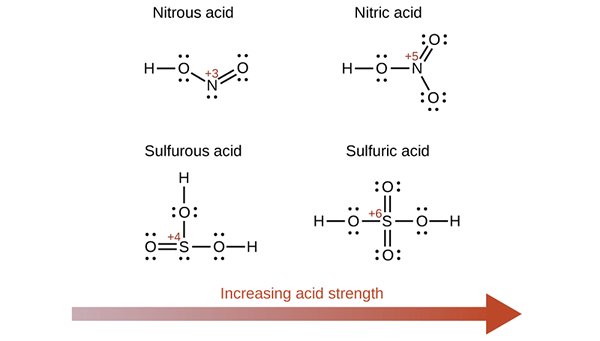
Gambar 02: Beberapa okyacid dan kekuatan asamnya
Kemampuan untuk menyumbangkan satu atau lebih proton sangat penting untuk menjadikan elemen itu menjadi asam. Hidrogen okyacid mengikat dengan atom oksigen. Oleh karena itu, pada asam ini, kita dapat menentukan keasaman dengan elektronegativitas atom sentral dan jumlah atom oksigen.
Apa perbedaan antara asam biner dan okyacids?
Asam biner adalah molekul, yang mengandung dua elemen; Satu elemen adalah hidrogen, dan yang lainnya adalah elemen non -logam. Sedangkan, okyacid adalah asam yang mengandung atom oksigen dalam molekul. Oleh karena itu, perbedaan utama antara asam biner dan okyacids adalah bahwa okyacid mengandung setidaknya satu atom oksigen dalam molekul, tetapi asam biner tidak mengandung oksigen.
Sebagai perbedaan signifikan lainnya antara asam biner dan okyacids, dalam okyacids, proton yang disumbangkan melekat pada atom oksigen. Pada asam biner, hidrogen melekat pada elemen non -logam lainnya.
Di bawah ini adalah infografis tentang perbedaan antara asam biner dan okyacids.

Ringkasan -Asam Biner vs Oxyacids
Asam biner dan okyacid adalah dua jenis senyawa asam. Perbedaan utama antara asam biner dan oksyacids adalah bahwa okyacid mengandung setidaknya satu atom oksigen dalam molekul dan asam biner tidak mengandung oksigen. Asam biner memiliki hidrogen dan elemen non-logam lainnya dalam molekul.
Referensi:
1. Helmenstine, Anne Marie, PH.D. “Definisi dan Contoh Oxyacid."Thoughtco, Jun. 22, 2018. Tersedia disini
2. Helmenstine, Anne Marie, PH.D. “Definisi asam biner."Thoughtco, Jun. 22, 2018. Tersedia disini
Gambar milik:
1.”CNX Chem 14 03 Oxyacid” oleh OpenStax (CC oleh 4.0) Via Commons Wikimedia


