Perbedaan antara model Bohr dan Rutherford
Perbedaan Utama - Model Bohr vs Rutherford
Konsep atom dan strukturnya pertama kali diperkenalkan oleh John Dolton pada tahun 1808. Dia menjelaskan hukum kombinasi kimia dengan mempertimbangkan atom -atom sebagai partikel yang tidak terlihat tanpa struktur. Kemudian pada tahun 1911, fisikawan Selandia Baru Ernest Rutherford mengusulkan bahwa atom terdiri dari dua komponen: inti yang bermuatan positif di tengah atom dan elektron bermuatan negatif di bagian ekstranuklear atom atom tersebut atom tersebut. Teori -teori tertentu seperti teori elektromagnetik yang disajikan oleh Maxwell tidak dapat dijelaskan dengan model Rutherford. Karena keterbatasan dalam model Rutherford, fisikawan Denmark Niels Bohr mengusulkan model baru pada tahun 1913 berdasarkan teori radiasi kuantum. Model Bohr sebagian besar diterima dan dia dianugerahi Hadiah Nobel untuk karyanya. Meskipun sebagian besar diterima, itu masih membawa kelemahan dan keterbatasan tertentu. Perbedaan utama antara model Bohr dan model Rutherford adalah itu Dalam model Rutherford, elektron dapat berputar di orbit apa pun di sekitar nukleus, sedangkan dalam model Bohr, elektron dapat berputar dalam cangkang yang pasti.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu model bohr
3. Apa itu model Rutherford
4. Perbandingan Berdampingan - Model Bohr vs Rutherford dalam bentuk tabel
6. Ringkasan
Apa itu model bohr?
Model Bohr diusulkan oleh Niels Bohr pada tahun 1922 untuk menjelaskan struktur atom. Dalam model ini, Bohr menyebutkan bahwa sebagian besar massa atom terletak pada nukleus pusat yang mengandung proton dan elektron diatur dalam tingkat energi yang pasti dan berputar di sekitar nukleus. Model ini juga mengusulkan konfigurasi elektronik, yang menjelaskan pengaturan elektron dalam orbit melingkar yang ditunjuk sebagai k, l, m, n, dll. Atom dengan konfigurasi elektron lengkap tidak aktif. Konfigurasi elektron menentukan reaktivitas atom.

Gambar 01: Model Bohr
Model Bohr mampu menjelaskan spektrum atom hidrogen, tetapi tidak dapat sepenuhnya menjelaskan reaktivitas atom multielektron. Selain itu, itu tidak menjelaskan efek Zeeman, di mana setiap garis spektral terpecah menjadi lebih banyak garis di hadapan medan magnet eksternal. Dalam model ini, elektron dianggap hanya sebagai partikel. Namun, seorang ahli fisika Prancis, De Broglie menemukan bahwa elektron memiliki sifat gelombang dan partikel. Kemudian, seorang fisikawan mengajukan prinsip lain yang disebut Prinsip Ketidakpastian Heisenberg, yang menjelaskan ketidakmungkinan penentuan simultan posisi dan momentum partikel bergerak kecil seperti elektron. Dengan penemuan ini, model Bohr menghadapi kemunduran yang serius.
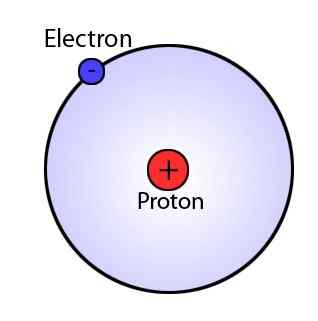
Apa itu model Rutherford?
Pada tahun 1911, Ernest Rutherford mengusulkan model Rutherford. Ini menyatakan bahwa atom (volume) terutama terdiri dari ruang dan massa atom berpusat di dalam nukleus, yang merupakan inti dari atom. Nukleus bermuatan positif dan orbit elektron di sekitar nukleus. Orbit tidak memiliki jalur yang pasti. Selain itu, karena atom netral, mereka memiliki positif yang sama (dalam nukleus) dan muatan negatif (elektron).

Gambar 02: Atom Rutherford
Model Rutherford gagal menjelaskan teori elektromagnetik, stabilitas atom dan keberadaan garis yang pasti dalam spektrum hidrogen.
Apa perbedaan antara model Bohr dan Rutherford?
Model Bohr vs Rutherford | |
| Model Bohr diusulkan oleh Niels Bohr pada tahun 1922. | Model Rutherford diusulkan oleh Ernest Rutherford pada tahun 1911. |
| Teori | |
| Sebagian besar massa atom terletak pada nukleus pusat, yang mengandung proton, dan elektron diatur dalam tingkat energi atau kerang yang pasti. | Sebagian besar atom terdiri dari ruang kosong. Pusat atom mengandung nukleus bermuatan positif dan elektron bermuatan negatif ada di ruang di sekitar nukleus. |
| Emisi radiasi elektron | |
| Elektron hanya memancarkan gelombang frekuensi yang pasti. | Elektron memancarkan gelombang dari semua frekuensi. |
| Spektrum emisi elektron | |
| Spektrum emisi elektron adalah spektrum garis. | Spektrum emisi elektron adalah spektrum kontinu. |
Ringkasan -Model Bohr vs Rutherford
Baik model Bohr dan Rutherford adalah model planet yang menjelaskan struktur atom hingga batas tertentu. Model -model ini memiliki keterbatasan dan tidak menjelaskan beberapa prinsip fisika modern. Namun, model -model ini sangat berkontribusi terhadap model canggih modern yang menjelaskan struktur atom. Model Bohr menyatakan bahwa sebagian besar massa atom berada di nukleus pusat, yang mengandung proton dan, bahwa elektron diatur dalam tingkat energi atau cangkang yang pasti, menghasilkan spektrum garis elektron. Model Rutherford menyatakan bahwa sebagian besar atom terdiri dari ruang kosong dan pusat atom berisi inti yang bermuatan positif dikelilingi oleh elektron bermuatan negatif, menghasilkan spektrum elektron kontinu yang berkelanjutan. Inilah perbedaan antara model Bohr dan Rutherford.
Unduh Versi PDF dari Bohr vs Rutherford Model
Anda dapat mengunduh versi PDF artikel ini dan menggunakannya untuk tujuan offline sesuai catatan kutipan. Silakan unduh Versi PDF di Sini Perbedaan Antara Bohr dan Rutherford Model.
Referensi:
1. Tarendash, a. S. Mari Tinjau: Kimia, Pengaturan Fisik. Seri Pendidikan Barron, 2006. Mencetak.
2. Warren, d. Ahli Kimia dalam Konteks Sosial dan Sejarah: Ahli Kimiawan adalah Orang Sejati, Hidup di Dunia Nyata. Royal Society of Chemistry, 2001. Mencetak.
Gambar milik:
1. "Bohr Model" oleh Jia.Liu - Pekerjaan Sendiri (Domain Publik) Via Commons Wikimedia
2. "Rutherford Atom" dengan karya sendiri (CreateJoder XD XD) (CC BY-SA 3.0) Via Commons Wikimedia


