Perbedaan antara ikatan dan orbital molekul antibonding
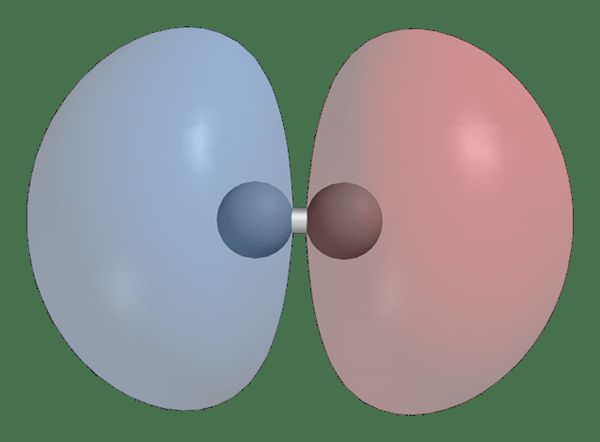
Ikatan vs orbital molekul antibonding
Perbedaan antara ikatan dan orbital molekul antibonding dapat dijelaskan dengan baik menggunakan “teori orbital molekuler.”Kedua jenis orbital molekul ini terbentuk ketika ikatan kimia kovalen terbentuk. Perbedaan paling signifikan antara ikatan dan orbital molekul antibonding adalah tingkat energinya dibandingkan dengan orbital atom induk. Perbedaan tingkat energi ini mengarah pada perbedaan lain antara dua orbital molekuler.
Orbital molekul ikatan dan antibonding dibentuk oleh orbital atom kombinasi linier. Konsep -konsep kunci berikut sangat penting, untuk memahami perbedaan antara ikatan dan orbital molekul antibonding.
Prinsip Aufbau - Orbital dengan energi terendah diisi terlebih dahulu.
Prinsip Pengecualian Pauli - Jumlah maksimum elektron (dengan putaran berlawanan) yang dapat menempati orbital adalah dua.
Aturan Hund - Ketika ada beberapa orbital molekul dengan energi yang sama, elektron menempati orbital molekul satu per satu sebelum dua menempati orbital molekul yang sama.
Apa itu orbital molekul ikatan?
Orbital molekul ikatan terbentuk dari orbital atom oleh Dalam fase kombinasi orbital atom. Itu meningkatkan kepadatan elektron antara atom terikat. Energi mereka lebih rendah dari orbital atom. Elektron pertama -tama diisi ke orbital molekul ikatan dan mereka menstabilkan molekul karena mereka mengaitkan lebih sedikit energi daripada elektron dalam atom induk.
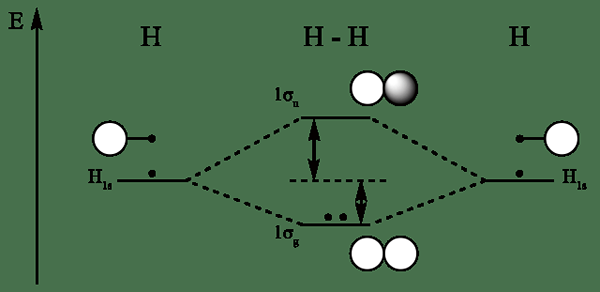
Diagram orbital molekul untuk hidrogen
Apa itu orbital molekul antibonding?
Orbital molekul antibonding dibentuk oleh di luar fase kombinasi orbital atom dan mengurangi kepadatan elektron antara dua atom. Dalam orbital molekul antibonding, energinya lebih tinggi dari orbital atom yang membentuknya. Karena fakta ini, ketika elektron diisi ke dalam orbital molekul antibonding, ia mengacaukan ikatan antara dua atom.

H2 1Sσ* Orbital Molekul Antibonding
Apa perbedaan antara orbital molekul ikatan dan orbital molekul antibonding?
• Energi:
ENERGIOrbital molekul antibonding > EnergiOrbital molekul ikatan
• Orbital molekul ikatan memiliki energi yang lebih rendah dibandingkan dengan orbital atom induk.
• Orbital molekul antibonding memiliki energi tinggi daripada orbital atom induk.
• Secara umum, elektron pertama kali diisi ke tingkat energi yang lebih rendah. Oleh karena itu, elektron pertama kali diisi ke orbital molekul ikatan dan kemudian ke orbital molekul antibonding.
• Stabilitas:
• Ikatan orbital molekul lebih stabil daripada orbital molekul antibonding dan orbital atom induk.
• Orbital molekul antibonding kurang stabil dibandingkan orbital molekul ikatan dan orptial atom induk.
• Alasan utama perbedaan stabilitas adalah perbedaan tingkat energi. Semakin tinggi energi lebih sedikit stabilitas. Turunkan energi lebih banyak stabilitas.
• Ketersediaan elektron:
• Probabilitas menemukan elektron sangat tinggi dalam orbital molekul ikatan.
• Menemukan elektron dalam orbital molekul antibonding minimum.
• Kontribusi untuk bentuk molekul:
• Orbital molekul ikatan berkontribusi langsung pada bentuk molekul.
• Orbital molekul antibonding tidak berkontribusi pada bentuk molekul.
Gambar milik:
- MO Diagram Hidrogen oleh CCOIL (CC BY-SA 3.0)
- H2 1Sσ* Orbital molekul antibonding melalui Wikicommons (domain publik)


