Perbedaan antara borazin dan diborane
Itu perbedaan utama antara borazin dan diborane adalah itu Borazin mengandung tiga atom boron per molekul, sedangkan diborane mengandung dua atom boron per molekul.
Borazin dan diborane adalah senyawa kimia yang mengandung boron. Keduanya adalah senyawa siklik dengan jumlah anggota cincin yang berbeda.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu Borazine
3. Apa itu Diborane
4. Perbandingan berdampingan - borazin vs diborane dalam bentuk tabel
5. Ringkasan
Apa itu Borazine?
Borazine adalah senyawa siklik, anorganik yang memiliki formula kimia B3H6N3. Ini adalah senyawa siklik dengan struktur cincin beranggotakan enam orang. Artinya, ia memiliki tiga unit B-H dan tiga unit N-H dalam pola bergantian. Oleh karena itu, kita dapat menulis formula kimianya sebagai (bh3) (NH3). Juga, struktur ini isoelektronik dengan cincin benzena. Seperti benzena, ini juga cairan yang tidak berwarna pada suhu kamar. Oleh karena itu, kadang -kadang kita menyebutnya "benzena anorganik".
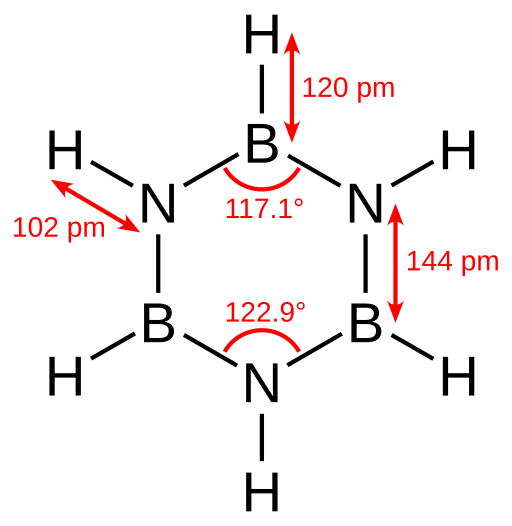
Gambar 01: Struktur Borazin
Selanjutnya, massa molar borazin adalah 80.50 g/mol. Titik lebur dan titik didih masing -masing −58 ° C dan 53 ° C. Itu juga memiliki aroma aromatik. Selain itu, ini adalah senyawa sintetis yang dapat kita hasilkan dari diborane dan amonia pada rasio 1: 2.
Reaksi kimia yang terlibat dalam proses ini adalah sebagai berikut:
3 b2H6 + 6 nh3 → 2 b3H6N3 + 12 jam2
Yang terpenting, jika kita menambahkan borazin ke dalam air, itu akan terhidrolisis untuk memberikan asam borat, amonia dan gas hidrogen. Selain itu, senyawa ini secara termal sangat stabil karena perubahan entalpi standar yang rendah; −531 kJ/mol. Dibandingkan dengan benzena, borazin jauh lebih reaktif. Misalnya, dapat bereaksi dengan hidrogen klorida sementara benzena tidak bisa.
Menurut penentuan kristalografi sinar-X, panjang ikatan dalam struktur cincin borazin sama. Namun, itu tidak dapat membentuk segi enam yang sempurna karena pola nitrogen dan boron bergantian memberikan sudut ikatan yang berbeda dan dengan demikian, simetri molekuler yang berbeda.
Apa itu Diborane?
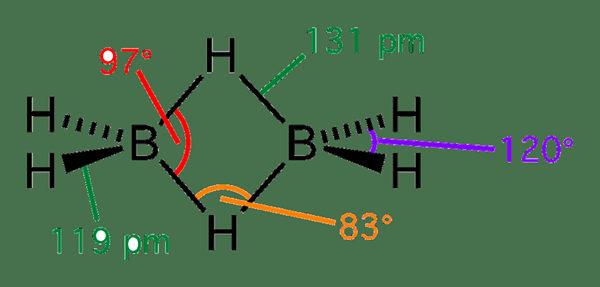
Diborane adalah senyawa anorganik yang memiliki formula kimia B2H6. Senyawa ini mengandung atom boron dan hidrogen dalam struktur siklik. Itu terjadi sebagai gas yang tidak berwarna dan piroforis. Itu memiliki bau manis yang menjijikkan juga. Massa molar diborane adalah 27.67 g/mol.

Gambar 02: Struktur diborane
Diborane dianggap sebagai molekul yang kekurangan elektron. Ini karena tidak memiliki cukup elektron valensi untuk membentuk ikatan dua elektron terpisah antara setiap pasangan atom terikat. Selain itu, itu adalah alasan struktur molekul diborane atau jembatan.
Saat mempertimbangkan sifat -sifat diborane, itu adalah gas yang tidak berwarna dan mudah terbakar pada suhu kamar. Itu juga merupakan gas beracun. Saat terbakar di hadapan oksigen di udara, diborane dapat melepaskan energi yang tinggi. Saat gas ini dicampur dengan air, dengan cepat menghidrolisis, memberikan asam borat dan gas hidrogen.
Apa perbedaan antara borazin dan diborane?
Perbedaan utama antara borazin dan diborane adalah bahwa borazin mengandung tiga atom boron per molekul, sedangkan diborane mengandung dua atom boron per molekul. Selain itu, perbedaan lain antara borazin dan diborane adalah bahwa borazin adalah cairan yang tidak berwarna, sedangkan diborane adalah gas yang tidak berwarna dan mudah terbakar. Selain itu, borazin terbentuk dari reaksi antara diborane dan amonia sementara diborane terbentuk dari reaksi antara logam hidrida dan boron.
Di bawah ini adalah tabulasi perbedaan antara borazin dan diborane.
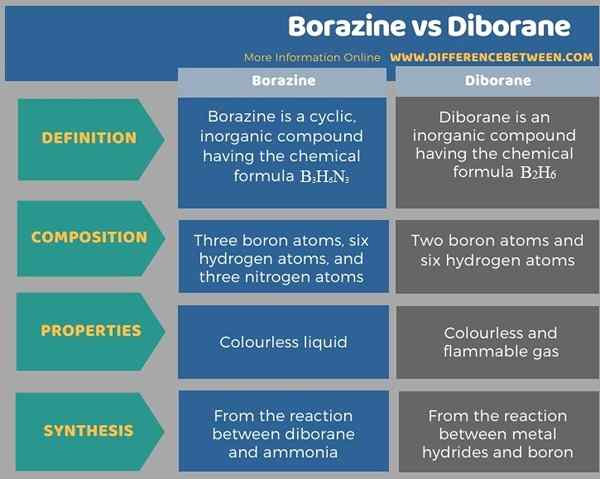
Ringkasan -Borazine vs Diborane
Borazin dan diborane adalah struktur siklik. Perbedaan utama antara borazin dan diborane adalah bahwa borazin mengandung tiga atom boron per molekul, sedangkan diborane mengandung dua atom boron per molekul.
Referensi:
“Diborane - Struktur Diborane, Persiapan, Properti, Penggunaan.”Byjus, Byju, 16 Des. 2019, tersedia di sini.
“Diborane.”Wikipedia, Wikimedia Foundation, 6 Feb. 2020, tersedia di sini.
Gambar milik:
1. “Borazine-Dimensions-2D” oleh HBF878-Karya Sendiri (CC0) via Commons Wikimedia
2. "Diborane-2D" (domain publik) melalui Commons Wikimedia


