Perbedaan antara bromin dan klorin

Itu perbedaan utama antara bromin dan klorin adalah itu Bromin kurang reaktif dari klorin.
Halogen adalah elemen grup VII dalam tabel periodik. Semua elemen ini adalah elemen elektronegatif dan memiliki kemampuan untuk menghasilkan anion -1. Anggota kelompok ini termasuk fluor, klorin, bromin, yodium dan astatin.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu bromin
3. Apa itu klorin
4. Perbandingan berdampingan - bromin vs klorin dalam bentuk tabel
5. Ringkasan
Apa itu bromin?
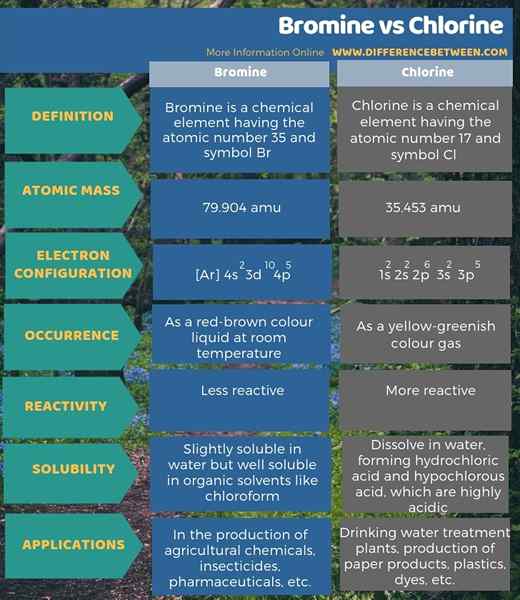
Bromin dilambangkan dengan simbol Br. Ini ada di 4th periode tabel periodik antara klorin dan yodium halogen. Konfigurasi elektronnya adalah [ar] 4s2 3d10 4p5. Selanjutnya, jumlah atom brom adalah 35. Massa atomnya adalah 79.904. Bromin tetap sebagai cairan warna merah-coklat pada suhu kamar. Itu ada sebagai molekul diatomik, BR2. Selain itu, ini beracun, korosif dan memiliki bau yang kuat.
Reaktivitas kimia bromin terletak di antara klorin dan yodium. Bromin kurang reaktif daripada klorin tetapi lebih reaktif daripada yodium. Itu menghasilkan ion bromida dengan mengambil satu elektron. Oleh karena itu, ia berpartisipasi dalam pembentukan senyawa ionik dengan mudah. Sebenarnya, di alam, bromin ada sebagai garam bromida, bukan Br2. Ada dua isotop brom yang stabil. 79Br (50.69%) dan 81Br (49.31%) adalah isotop tersebut.

Gambar 01: Sampel bromin
Bromin sedikit larut dalam air tetapi larut dalam pelarut organik seperti kloroform. Ini dapat diproduksi dengan mengobati air asin kaya bromida dengan gas klor, atau gas brom dapat diproduksi dengan mengobati HBR dengan asam sulfat. Selanjutnya, ini sangat penting di laboratorium industri dan kimia. Senyawa bromida berguna sebagai aditif bensin dan untuk pestisida.
Apa itu klorin?
Klorin adalah elemen dalam tabel periodik yang kami tunjukkan oleh CL. Itu adalah halogen (17th grup) di 3rd periode tabel periodik. Jumlah atom klorin adalah 17; Dengan demikian, ia memiliki tujuh belas proton dan tujuh belas elektron. Konfigurasi elektronnya adalah 1S2 2S2 2P6 3S2 3p5. Sejak P Sublevel harus memiliki 6 elektron untuk mendapatkan konfigurasi elektron gas argon, klorin memiliki kemampuan untuk menarik elektron.

Gambar 02: Sampel klorin
Klorin memiliki elektronegativitas yang sangat tinggi, yaitu sekitar 3, menurut skala Pauling. Selain itu, berat atom klorin adalah 35.453 Amu. Di bawah suhu kamar, itu ada sebagai molekul diatomik (CL2). Cl2 adalah gas warna kuning-hijau.
Klorin memiliki titik leleh -101.5 ° C dan titik didih -34.04 ° C. Di antara semua isotop klorin, CL-35 dan CL-37 adalah isotop yang paling stabil. Saat gas klorin larut dalam air, ia membentuk asam klorida dan asam hipoklora, yang sangat asam.
Klorin memiliki semua bilangan oksidasi yang bervariasi dari -1 hingga +7. Selanjutnya, ini adalah gas yang sangat reaktif. Itu dapat melepaskan bromin dan yodium dari garam bromida dan iodida, masing -masing. Oleh karena itu, ia memiliki kemampuan untuk oksida anion elemen yang terletak di bawah klorin dalam tabel periodik. Namun, tidak dapat mengoksidasi fluoride untuk memberikan fluor. Klorin terutama diproduksi oleh elektrolisis larutan natrium klorida. Kemudian di anoda, kita bisa mengumpulkan gas klorin. Klorin terutama penting sebagai desinfektan dalam pemurnian air. Selanjutnya, ini berguna dalam pembuatan berbagai produk konsumen seperti makanan, insektisida, cat, produk minyak bumi, plastik, obat -obatan, tekstil, pelarut.
Apa perbedaan antara bromin dan klorin?
Bromin adalah elemen kimia yang memiliki nomor atom 35 dan simbol BR sedangkan klorin adalah elemen kimia yang memiliki nomor atom 17 dan simbol CL. Perbedaan utama antara bromin dan klorin adalah bahwa bromin kurang reaktif daripada klorin.
Selain itu, massa atom bromin dan klorin adalah 79.904 Amu dan 35.453 AMU, masing -masing. Juga, perbedaan lebih lanjut antara bromin dan klorin adalah bahwa bromin terjadi sebagai cairan warna merah-coklat pada suhu kamar, sedangkan klorin terjadi sebagai gas warna kuning-hijau.
Di bawah ini adalah ringkasan perbedaan antara bromin dan klorin dalam bentuk tabel.
Ringkasan -Bromine vs Klorin
Bromin adalah elemen kimia yang memiliki nomor atom 35 dan simbol Br. Klorin adalah elemen kimia yang memiliki nomor atom 17 dan simbol cl. Singkatnya, perbedaan utama antara bromin dan klorin adalah bahwa bromin kurang reaktif daripada klorin.
Referensi:
1. “Bromine - Informasi Elemen, Properti dan Penggunaan | Tabel periodik.”Royal Society of Chemistry - Kemajuan Keunggulan dalam Ilmu Kimia, Tersedia Di Sini.
Gambar milik:
1. "Bromine -Ampoule" oleh Jurii - (CC oleh 3.0) Via Commons Wikimedia
2. “Klorin-sampel” oleh Benjah-BMM27-karya sendiri (domain publik) melalui Commons Wikimedia