Perbedaan antara sel elektrokimia dan sel galvanik
Itu perbedaan utama antara sel elektrokimia dan sel galvanik adalah itu Sebagian besar sel elektrokimia cenderung mengubah energi listrik menjadi energi kimia, sedangkan sel galvanik cenderung mengubah energi kimia menjadi energi listrik.
Reaksi oksidasi dan reduksi memainkan peran penting dalam elektrokimia. Dalam reaksi reduksi oksidasi, elektron ditransfer dari satu reaktan ke yang lain. Zat yang menerima elektron adalah zat pereduksi, sedangkan zat yang memberikan elektron adalah zat pengoksidasi. Agen pereduksi bertanggung jawab untuk mengurangi reaktan lain saat menjalani oksidasi itu sendiri; Untuk agen pengoksidasi, ini sebaliknya. Reaksi-reaksi ini terjadi dalam dua reaksi setengah untuk menunjukkan oksidasi dan pengurangan terpisah; Dengan demikian, ini menunjukkan jumlah elektron yang bergerak masuk atau keluar.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu sel elektrokimia
3. Apa itu sel galvanik
4. Perbandingan berdampingan - sel elektrokimia vs sel galvanik dalam bentuk tabel
5. Ringkasan
Apa itu sel elektrokimia?
Sel elektrokimia adalah kombinasi dari agen pereduksi dan pengoksidasi, yang secara fisik terpisah satu sama lain. Biasanya, kami melakukan pemisahan ini dengan jembatan garam. Meskipun mereka dipisahkan secara fisik, kedua sel setengah bersentuhan satu sama lain. Sel elektrolitik dan galvanik adalah dua jenis sel elektrokimia.
Reaksi reduksi oksidasi terjadi pada sel elektrolitik dan galvanik. Oleh karena itu, dalam sel elektrokimia, ada dua elektroda sebagai anoda dan katoda. Kedua elektroda terhubung secara eksternal dengan voltmeter tahan tinggi; Oleh karena itu, arus tidak ada transmisi di antara elektroda. Oleh karena itu, voltmeter ini membantu mempertahankan tegangan tertentu antara elektroda di mana reaksi oksidasi terjadi.

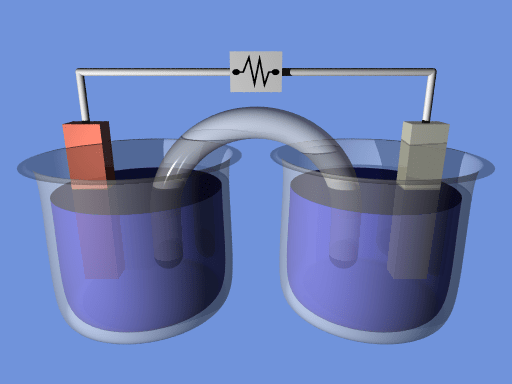
Gambar 01: Sel Elektrokimia
Reaksi oksidasi terjadi pada anoda, sedangkan reaksi reduksi terjadi pada katoda. Kita perlu membenamkannya dalam solusi elektrolit yang terpisah. Biasanya, solusi ini adalah solusi ionik yang terkait dengan jenis elektroda. Sebagai contoh, kami membenamkan elektroda tembaga dalam larutan tembaga sulfat dan elektroda perak dalam larutan perak klorida. Solusi ini berbeda; Oleh karena itu, mereka harus dipisahkan. Cara paling umum untuk memisahkannya adalah jembatan garam. Dalam sel elektrokimia, energi potensial sel dikonversi menjadi arus listrik, yang dapat kita gunakan untuk menyalakan bohlam atau untuk melakukan beberapa pekerjaan listrik lainnya.
Apa itu sel galvanik?
Sel galvanik atau volta menyimpan energi listrik. Baterai terbuat dari serangkaian sel galvanik untuk menghasilkan tegangan yang lebih tinggi. Reaksi pada dua elektroda dalam sel galvanik cenderung dilanjutkan secara spontan. Saat reaksi terjadi, ada aliran elektron dari anoda ke katoda melalui konduktor eksternal.
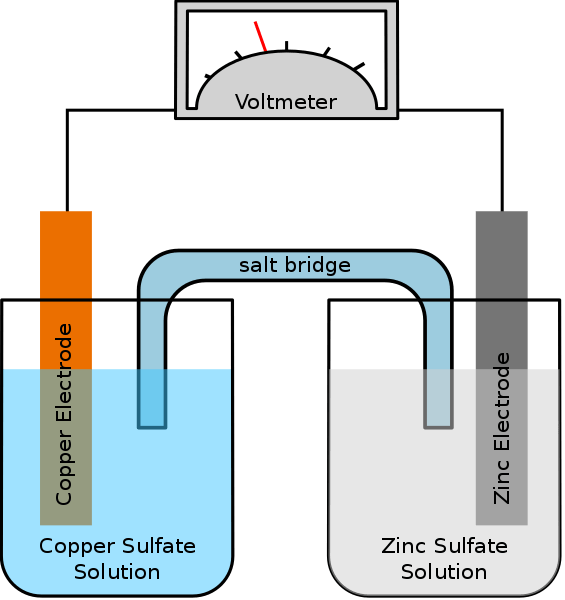
Gambar 02: Sel galvanik
Misalnya, jika kedua elektroda tersebut bersifat perak dan tembaga dalam sel galvanik, elektroda perak positif sehubungan dengan elektroda tembaga. Elektroda tembaga adalah anoda, dan mengalami reaksi oksidasi dan melepaskan elektron. Elektron ini pergi ke katoda perak melalui sirkuit eksternal. Oleh karena itu, katoda perak mengalami reaksi reduksi. Perbedaan potensial dihasilkan antara dua elektroda, yang memungkinkan aliran elektron. Berikut ini adalah reaksi sel spontan dari sel galvanik di atas.
2 Ag+ (aq) + cu (s) ⇌ 2ag (s) + cu2+ (aq)
Apa perbedaan antara sel elektrokimia dan sel galvanik?
Ada dua jenis sel elektrokimia sebagai sel elektrolitik dan sel galvanik. Perbedaan utama antara sel elektrokimia dan sel galvanik adalah bahwa sebagian besar sel elektrokimia cenderung mengubah energi listrik menjadi energi kimia, sedangkan sel galvanik cenderung mengubah energi kimia menjadi energi listrik. Selain itu, dalam sebagian besar sel elektrokimia seperti sel elektrolitik, anoda adalah terminal positif sedangkan katoda adalah terminal negatif; Namun, dalam sel galvanik, anoda adalah terminal negatif dan katoda adalah terminal positif.
Selain itu, perbedaan lebih lanjut antara sel elektrokimia dan sel galvanik adalah bahwa dalam sel elektrokimia, seperti sel elektrolitik, reaksi kimia non-spontan terjadi, tetapi dalam sel galvanik, reaksi kimia spontan terjadi.
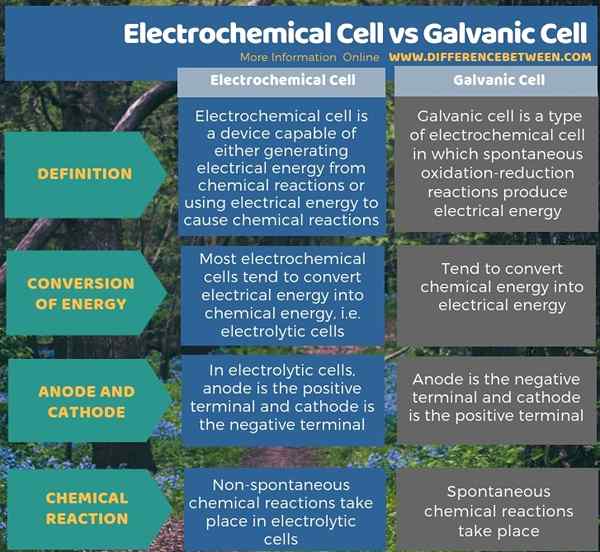
Ringkasan -Elektrokimia VS dan sel galvanik
Ada dua jenis sel elektrokimia sebagai sel elektrolitik dan sel galvanik. Perbedaan utama antara sel elektrokimia dan sel galvanik adalah bahwa sebagian besar sel elektrokimia cenderung mengubah energi listrik menjadi energi kimia, sedangkan sel galvanik cenderung mengubah energi kimia menjadi energi listrik.
Referensi:
1.“Sel Elektrokimia." Sel Elektrokimia - Gambaran Umum | Topik ScienceDirect, Tersedia disini.
Gambar milik:
1. "Electrochemcel" oleh Alksub di Inggris Wikipedia (CC BY-SA 3.0) Via Commons Wikimedia
2. "Galvanic Cell" oleh Gringer - File: Galvanische Zelle.PNG, oleh Tinux (CC BY-SA 3.0) Via Commons Wikimedia


