Perbedaan antara kalsium klorida dan natrium klorida

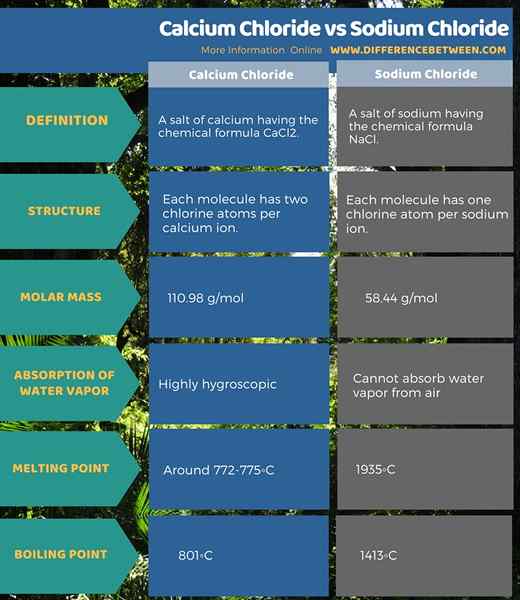
Itu perbedaan utama antara kalsium klorida dan natrium klorida adalah itu Molekul kalsium klorida memiliki dua atom klorin sedangkan molekul natrium klorida memiliki satu atom klorin. Lebih lanjut, kalsium klorida adalah bubuk berwarna putih dengan sifat higroskopis sedangkan, natrium klorida adalah kristal yang tidak berwarna dan natrium klorida murni bukan higroskopis.
Baik kalsium klorida dan natrium klorida adalah senyawa alorganik, alkali. Formula kimia kalsium klorida adalah CACL2. Formula kimia natrium klorida adalah NaCl.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu kalsium klorida
3. Apa itu natrium klorida
4. Perbandingan berdampingan - kalsium klorida vs natrium klorida dalam bentuk tabel
5. Ringkasan
Apa itu kalsium klorida?
Kalsium klorida adalah CaCl2 yang memiliki massa molar 110.98 g/mol. Itu muncul sebagai senyawa padat putih yang higroskopis. Ini berarti dapat menyerap uap air dari udara saat terpapar ke atmosfer. Senyawa ini tidak berbau. Itu termasuk dalam kategori garam; Kami menyebutnya garam kalsium.
Senyawa ini sangat larut dalam air. Karena sifatnya yang higroskopis, senyawa ini biasanya terjadi sebagai kompleks terhidrasi. Formula kompleks terhidrasi ini adalah CaCl2.(H2o) x di mana x = 0, 1, 2, 4 dan 6. Senyawa terhidrasi ini berguna dalam proses de-icing dan mengendalikan debu. Bentuk anhidrat (di mana x = 0) penting sebagai keturunan karena sifat higroskopis.

Gambar 01: Penampilan kalsium klorida
Titik leleh kalsium klorida anhidrat adalah sekitar 772-775◦C saat titik didih adalah tahun 1935◦C. Ketika kita melarutkan senyawa ini dalam air, itu membentuk kompleks hexaaqua; [CA (H2HAI)6]2+. Ini mengubah ion kalsium dan klorida dalam larutan menjadi keadaan "bebas". Oleh karena itu, jika kita menambahkan sumber fosfat ke larutan berair ini, itu memberikan endapan padat kalsium fosfat.
Apa itu natrium klorida?
Sodium klorida adalah NaCl yang memiliki massa molar 58.44 g/mol. Pada suhu dan tekanan kamar, senyawa ini muncul sebagai kristal padat dan tidak berwarna. Itu tidak berbau. Dalam bentuk murni, senyawa ini tidak dapat menyerap uap air. Oleh karena itu, itu bukan higroskopis.
Sodium klorida juga merupakan garam; Kami menyebutnya garam natrium. Ada satu atom porselat per setiap atom natrium molekul. Garam ini bertanggung jawab atas salinitas air laut. Titik leleh adalah 801◦C saat titik didih adalah 1413◦C. Dalam kristal natrium klorida, setiap kation natrium dikelilingi dengan enam ion klorida dan sebaliknya. Oleh karena itu, kami menyebut sistem kristal sebagai sistem kubik yang berpusat pada wajah.

Gambar 02: Kristal Garam
Senyawa ini larut dalam senyawa polar tinggi seperti air. Di sana, molekul air mengelilingi setiap kation dan anion. Setiap ion memiliki, sebagian besar waktu, enam molekul air di sekitarnya. Namun, pH natrium klorida berair terletak di sekitar pH7 karena kesedihan yang lemah dari ion klorida. Kami mengatakan, tidak ada efek natrium klorida pada pH larutan.
Apa perbedaan antara kalsium klorida dan natrium klorida?
Kalsium klorida adalah garam kalsium yang memiliki formula kimia CACL2 Sedangkan natrium klorida adalah garam natrium yang memiliki formula kimia NaCl. Keduanya adalah senyawa garam. Selain itu, setiap molekul kalsium klorida memiliki dua atom klorin per ion kalsium sementara setiap molekul natrium klorida memiliki satu atom klor per natrium ion. Selain itu, massa molar mereka berbeda satu sama lain juga; Massa molar kalsium klorida adalah 110.98 g/mol, dan massa molar natrium klorida adalah 58.44 g/mol.
Ringkasan -kalsium klorida vs natrium klorida
Kalsium klorida dan natrium klorida adalah senyawa garam yang basa. Kedua senyawa ini mengandung ion klorida dalam strukturnya, tetapi dalam rasio yang berbeda. Perbedaan utama antara kalsium klorida dan natrium klorida adalah bahwa satu molekul kalsium klorida memiliki dua atom klorin sedangkan satu molekul natrium klorida memiliki satu atom klorin.
Referensi:
1. “Kalsium Dichloride."Informasi Nasional untuk Informasi Bioteknologi. Basis Data Senyawa Pubchem. U.S. Perpustakaan Kedokteran Nasional. Tersedia disini
2. "Natrium klorida."Informasi Nasional untuk Informasi Bioteknologi. Database senyawa pubchem, u.S. Perpustakaan Kedokteran Nasional. Tersedia disini
Gambar milik:
1.'Kalsium klorida CaCl2'by tidak ada penulis yang dapat dibaca mesin yang disediakan. (CC BY-SA 3.0) Via Commons Wikimedia
2.'Halit-kristalle'by w.J.Pilsak di Wikipedia Jerman (CC BY-SA 3.0) Via Commons Wikimedia


