Perbedaan antara ikatan dπ-dπ dan ikatan delta
Itu perbedaan utama Antara ikatan dπ-dπ dan ikatan delta adalah itu Bondik Dπ-Dπ Terbentuk antara orbital atom D yang diisi dan orbital atom D yang kosong sedangkan ikatan delta terbentuk antara empat lobus dari satu orbital atom yang terlibat dan empat lobus dari orbital atom lainnya yang terlibat terlibat.
Baik ikatan dπ-dπ dan bentuk ikatan delta melalui tumpang tindih orbital atom. Tumpang tindih orbital dalam pembentukan ikatan dπ-dπ menciptakan ikatan koordinat sementara yang tumpang tindih dalam pembentukan ikatan delta membentuk ikatan kimia kovalen.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu ikatan dπ-dπ
3. Apa itu Delta Bond
4. Perbandingan berdampingan - ikatan dπ -dπ vs ikatan delta dalam bentuk tabel
5. Ringkasan
Apa itu ikatan dπ-dπ?
Ikatan Dπ-Dπ adalah jenis ikatan kimia kovalen di mana logam mengikat dengan ligan melalui tumpang tindih orbital D mereka. Dengan kata lain, jenis ikatan kimia kovalen ini terbentuk ketika orbital yang diisi dari logam transisi menyumbangkan beberapa elektronnya ke orbital kosong ligan untuk membentuk ikatan kimia koordinasi. Oleh karena itu, senyawa kimia ini dinamai kompleks koordinasi.
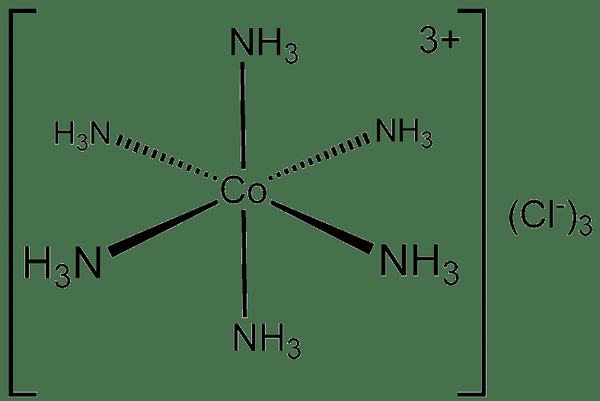
Gambar 01: Senyawa kovalen koordinat
Tidak seperti ikatan delta, yang menyerupai struktur ikatan dπ-dπ, ikatan dπ-dπ terjadi antara orbital D yang diisi dan orbital D yang kosong. Juga, ikatan delta dapat terjadi antara dua atom yang melibatkan orbital atom sementara ikatan dπ-dπ terjadi antara logam transisi yang telah menyelesaikan konfigurasi elektron D dan ligan yang memiliki orbital kosong dalam cangkang elektron D.
Apa itu ikatan delta?
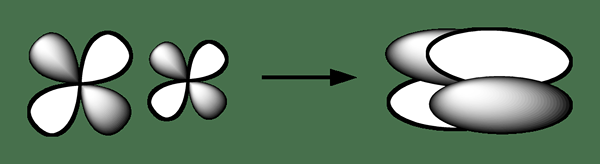
Ikatan delta adalah jenis ikatan kimia di mana empat lobus dari satu orbital atom yang terlibat cenderung tumpang tindih dengan empat lobus dari orbital atom yang terlibat untuk membentuk ikatan ini. Jenis orbital tumpang tindih ini mengarah pada pembentukan orbital molekul (ikatan) yang terdiri dari dua bidang nodal yang mengandung sumbu internuklear, dan yang melewati kedua atom. Surat Yunani untuk Delta Sign "" digunakan untuk notasi obligasi delta.

Gambar 02: Pembentukan ikatan kimia delta
Secara umum, simetri orbital dari ikatan delta mirip dengan jenis orbital atom D yang biasa saat mempertimbangkan sumbu ikatan. Kita dapat mengamati jenis ikatan kimia dalam atom yang telah menempati orbital atom D yang mengandung energi rendah untuk berpartisipasi dalam ikatan kimia kovalen. Misalnya, logam transisi yang ada dalam spesies kimia organometalik menunjukkan ikatan delta; Senyawa kimia dari beberapa logam seperti rhenium, molibdenum, dan kromium mengandung ikatan empat kali lipat. Ikatan quadruple terdiri dari ikatan sigma, dua ikatan pi, dan ikatan delta.
Saat mempertimbangkan simetri orbital dari ikatan delta, kita dapat mengamati bahwa simetri berbeda dari orbital antibondasi PI. Orbital antibonding PI berisi satu bidang nodal yang terdiri dari sumbu internuklear dan bidang nodal lain yang tegak lurus terhadap sumbu antara atom.
Ilmuwan Robert Mulliken memperkenalkan notasi Delta pada tahun 1931. Dia mengidentifikasi ikatan ini terlebih dahulu menggunakan senyawa kimia kalium octachlorodirhenate (III).
Apa perbedaan antara ikatan dπ-dπ dan ikatan delta?
ikatan dπ-dπ dan ikatan delta adalah dua jenis ikatan kimia kovalen. Perbedaan utama antara ikatan dπ-dπ dan ikatan delta adalah bahwa ikatan dπ-dπ terbentuk antara orbital atom D yang diisi dan orbital atom D yang kosong sedangkan ikatan delta terbentuk antara empat lobus dari satu orbital atom yang terlibat dan empat lobus dari orbital atom yang terlibat yang terlibat atom yang terlibat atomik yang terlibat atomik yang terlibat atom yang terlibat atom yang terlibat atom yang terlibat terlibat terlibat atomik yang terlibat atomik yang terlibat atom yang terlibat atom yang terlibat atom yang terlibat atom terlibat terlibat dan empat lobus orbital atom atom yang terlibat terlibat terlibat terlibat atomik terlibat.
Sebelum infografis merangkum perbedaan antara ikatan dπ-dπ dan ikatan delta dalam bentuk tabel.
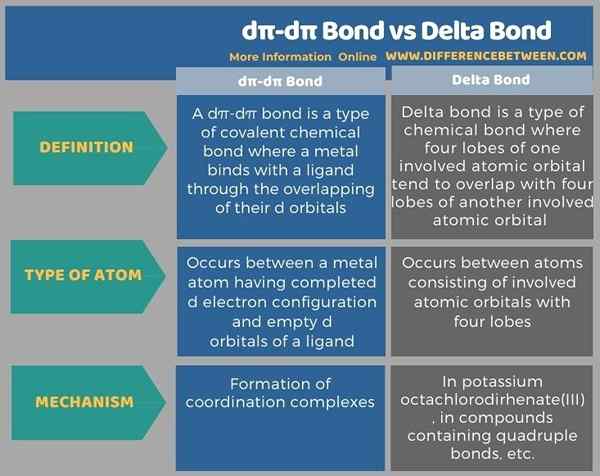
Ringkasan -ikatan dπ -dπ vs delta bond
ikatan dπ-dπ dan ikatan delta adalah dua jenis ikatan kimia kovalen. Perbedaan utama antara ikatan dπ-dπ dan ikatan delta adalah bahwa ikatan dπ-dπ terbentuk antara orbital atom D yang diisi dan orbital atom D yang kosong sedangkan ikatan delta terbentuk antara empat lobus dari satu orbital atom yang terlibat dan empat lobus dari orbital atom yang terlibat yang terlibat atom yang terlibat atomik yang terlibat atomik yang terlibat atom yang terlibat atom yang terlibat atom yang terlibat terlibat terlibat atomik yang terlibat atomik yang terlibat atom yang terlibat atom yang terlibat atom yang terlibat atom terlibat terlibat dan empat lobus orbital atom atom yang terlibat terlibat terlibat terlibat atomik terlibat.
Gambar milik:
1. “CoA6Cl3” - Smokefoot Diasumsikan - Tidak ada sumber yang dapat dibaca mesin yang disediakan. Pekerjaan sendiri diasumsikan (berdasarkan klaim hak cipta). (Domain publik) via commons wikimedia
2. "Delta-Bond-Formation-2D" oleh Ben Mills-karya sendiri (domain publik) melalui Commons Wikimedia