Perbedaan antara elektrolit dan nonelektrolit
Itu perbedaan utama Antara elektrolit dan nonelektrolit adalah itu elektrolit dapat menghasilkan ion saat dilarutkan dalam air, sedangkan nonelektrolit tidak dapat menghasilkan ion.
Kami dapat mengkategorikan semua senyawa menjadi dua kelompok sebagai elektrolit dan nonelektrolit tergantung pada kemampuannya untuk menghasilkan ion dan melaksanakan listrik. Proses melewati arus melalui larutan elektrolitik dan memaksa ion positif dan negatif untuk bergerak ke arah elektroda masing -masing disebut “elektrolisis."Namun, non -elektrolit tidak dapat mengambil bagian dalam proses elektrolisis.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu elektrolit
3. Apa itu nonelektrolit
4. Perbandingan berdampingan - elektrolit vs nonelektrolit dalam bentuk tabel
5. Ringkasan
Apa itu elektrolit?
Elektrolit adalah zat yang menghasilkan ion. Senyawa ini dapat menghasilkan ion ketika mereka berada dalam tahap cair, atau ketika mereka dilarutkan dalam pelarut (air). Karena ion, elektrolit dapat menghantarkan listrik. Ada juga elektrolit solid-state. Selain itu, beberapa gas seperti karbon dioksida menghasilkan ion (ion hidrogen dan bikarbonat) saat larut dalam air.
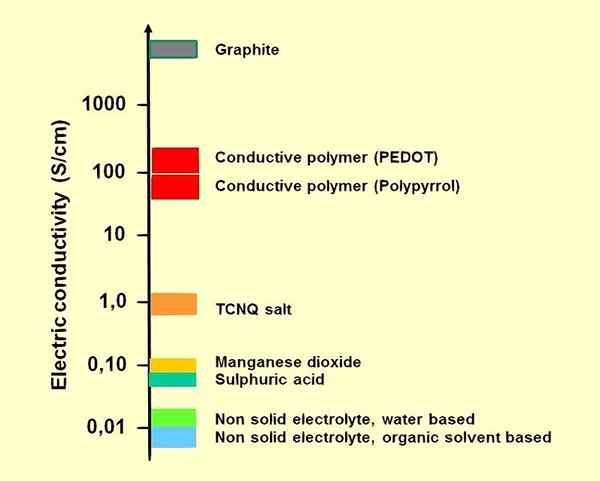
Ada dua jenis elektrolit: elektrolit yang kuat dan elektrolit lemah. Elektrolit yang kuat mudah menghasilkan ion saat larut. Misalnya, senyawa ionik adalah elektrolit yang kuat. Sodium klorida cair atau larutan NaCl berair mengalami disosiasi lengkap (ke dalam Na+dan cl-ion); Dengan demikian mereka adalah konduktor listrik yang baik. Asam dan basa kuat juga elektrolit yang baik. Elektrolit lemah menghasilkan beberapa ion saat larut dalam air. Selanjutnya, asam lemah seperti asam asetat dan basa lemah adalah elektrolit lemah.

Gambar 01: Beberapa elektrolit dibandingkan
Elektrolit di dalam tubuh
Elektrolit juga hadir di tubuh kita. Kita membutuhkan mereka untuk menjaga keseimbangan di dalam sel dan cairan darah dalam tubuh yang sehat. Keseimbangan elektrolit sangat penting untuk menjaga keseimbangan osmotik dan tekanan darah di dalam tubuh. Na+, K+, dan ca2+ penting dalam penularan impuls saraf dan kontraksi otot.
Berbagai hormon dalam homeostasis elektrolit kontrol tubuh. Misalnya, aldosteron mengontrol jumlah Na+. Hormon kalsitonin dan parathormon berperan untuk mempertahankan CA2+ dan po43- keseimbangan. Kita dapat mengukur kadar elektrolit darah untuk mengidentifikasi ketidakseimbangan elektrolit tertentu. Kebanyakan, na+ dan k+ Tingkat dalam pengukuran darah dan urin penting untuk memeriksa kerusakan ginjal. Na normal+ Level dalam darah adalah 135 - 145 mmol/L sedangkan k normal+ Level adalah 3.5 - 5.0 mmol/l. Tingkat elektrolit yang ekstrem dalam tubuh bisa berakibat fatal. Elektrolit juga penting dalam tubuh tanaman. Misalnya, elektrolit (k+) Kontrol mekanisme pembukaan dan penutupan stomata dengan sel penjaga.
Apa itu nonelektrolit?
Senyawa yang tidak dibagi menjadi ion positif dan negatif ketika kita melarutkannya dalam pelarut adalah nonelektrolit. Tahap cair dari senyawa ini juga tidak menghasilkan ion. Tidak adanya ion dalam medium membuatnya tidak konduktif. Sebagian besar, senyawa dengan ikatan kovalen nonpolar/ senyawa organik termasuk dalam kelompok ini. Misalnya, sukrosa, glukosa, etana, dll.
Apa perbedaan antara elektrolit dan non -elektrolit?
Perbedaan utama antara elektrolit dan nonelektrolit adalah bahwa elektrolit dapat menghasilkan ion ketika mereka dilarutkan dalam air sementara nonelektrolit tidak dapat menghasilkan ion. Senyawa ionik dan beberapa senyawa dengan ikatan kutub dapat berupa elektrolit. Senyawa dengan ikatan nonpolar sebagian besar adalah non -elektrolit. Selain itu, elektrolit dalam larutan dapat melakukan listrik yang bertentangan dengan nonelektrolit.
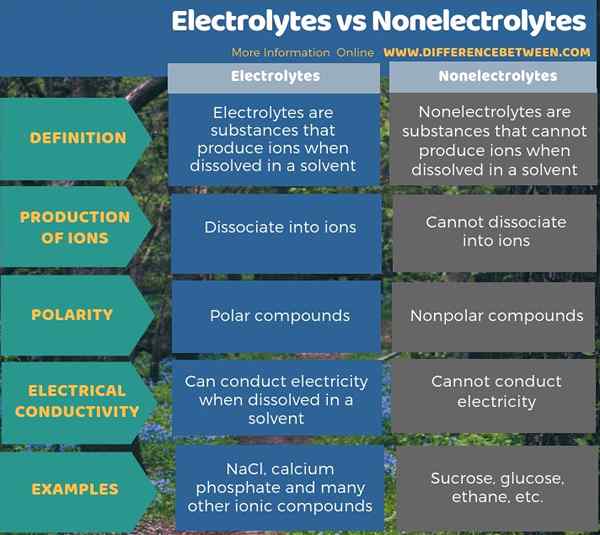
Ringkasan -Elektrolit vs Nonelektrolit
Semua senyawa yang kita tahu adalah elektrolit atau nonelektrolit. Perbedaan utama antara elektrolit dan nonelektrolit adalah bahwa elektrolit dapat menghasilkan ion ketika mereka dilarutkan dalam air, tetapi nonelektrolit tidak dapat menghasilkan ion.
Referensi:
1. Helmenstine, Anne Marie. “Definisi dan contoh elektrolit yang kuat."Thoughtco, Jul. 3, 2019, tersedia di sini.
2. Helmenstine, Anne Marie. “Contoh Kimia: Elektrolit Kuat dan Lemah."Thoughtco, Aug. 6, 2019, tersedia di sini.
Gambar milik:
1. “Konduktivitas Elektrolit -Bantara” oleh Elcap - Pekerjaan Sendiri (CC0) via Commons Wikimedia


