Perbedaan antara elektronegativitas dan energi ionisasi
Itu perbedaan utama antara elektronegativitas dan energi ionisasi adalah itu elektronegativitas menjelaskan daya tarik elektron sementara energi ionisasi mengacu pada penghapusan elektron dari atom.
Atom adalah blok bangunan dari semua zat yang ada. Mereka sangat kecil sehingga kita bahkan tidak bisa mengamatinya dengan mata telanjang kita. Atom terdiri dari nukleus, yang memiliki proton dan neutron. Selain neutron dan positron, ada partikel subatomik kecil lainnya dalam nukleus, dan ada elektron yang berputar -putar di sekitar nukleus dalam orbital. Karena adanya proton, inti atom memiliki muatan positif. Elektron di bola luar memiliki muatan negatif. Oleh karena itu, kekuatan menarik antara muatan positif dan negatif atom mempertahankan strukturnya.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu elektronegativitas
3. Apa itu energi ionisasi
4. Perbandingan berdampingan -elektronegativitas vs energi ionisasi dalam bentuk tabel
5. Ringkasan
Apa itu elektronegativitas?
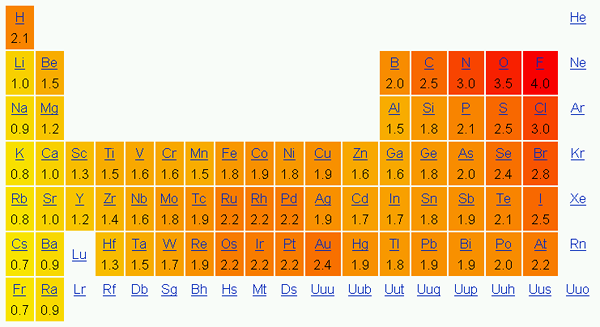
Elektronegativitas adalah kecenderungan atom untuk menarik elektron dalam ikatan ke arahnya. Dengan kata lain, ini menunjukkan daya tarik atom terhadap elektron. Kami biasanya menggunakan skala Pauling untuk menunjukkan elektronegativitas elemen.
Dalam tabel periodik, elektronegativitas berubah sesuai dengan suatu pola. Dari kiri ke kanan pada periode, elektronegativitas meningkat, dan dari atas ke bawah pada kelompok, elektronegativitas berkurang. Oleh karena itu, fluor adalah elemen paling elektronegatif dengan nilai 4.0 pada skala Pauling. Grup Satu dan Dua Elemen memiliki lebih sedikit elektronegativitas; Dengan demikian, mereka cenderung membentuk ion positif dengan memberikan elektron. Karena kelompok 5, 6, 7 elemen memiliki nilai elektronegativitas yang lebih tinggi, mereka suka mengambil elektron dalam dan dari ion negatif.
Gambar 01: Elektronegativitas Menurut Skala Pauling
Elektronegativitas juga penting dalam menentukan sifat ikatan. Jika dua atom dalam ikatan tidak memiliki perbedaan elektronegativitas, maka ikatan kovalen murni akan terbentuk. Selain itu, jika perbedaan elektronegativitas antara keduanya tinggi, maka ikatan ionik akan menjadi hasilnya. Jika ada sedikit perbedaan, ikatan kovalen kutub akan terbentuk.
Apa itu energi ionisasi?
Energi ionisasi adalah energi yang harus diberikan kepada atom netral untuk menghilangkan elektron darinya. Penghapusan elektron berarti menghilangkannya jarak yang tak terbatas dari spesies sehingga tidak ada gaya tarik antara elektron dan nukleus (pemindahan total).
Kita dapat menyebutkan energi ionisasi sebagai energi ionisasi pertama, energi ionisasi kedua dan sebagainya, tergantung pada jumlah elektron yang dikeluarkan dari atom. Pada saat yang sama, ini akan memunculkan kation dengan biaya +1, +2, +3, dan sebagainya.

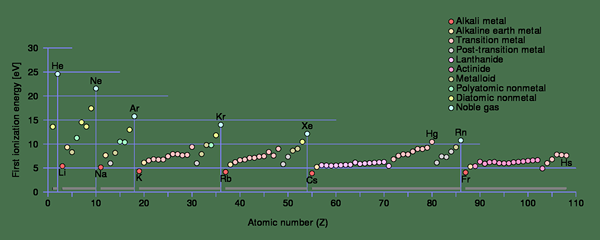
Gambar 1: Tren energi ionisasi untuk ionisasi pertama di setiap periode tabel periodik
Dalam atom kecil, jari -jari atomnya kecil. Oleh karena itu, gaya tarik elektrostatik antara elektron dan neutron jauh lebih tinggi dibandingkan dengan atom dengan jari -jari atom yang lebih besar. Itu meningkatkan energi ionisasi atom kecil. Jika elektron lebih dekat ke nukleus, energi ionisasi akan lebih tinggi.
Selain itu, energi ionisasi pertama dari atom yang berbeda juga bervariasi. Misalnya, energi ionisasi pertama natrium (496 kJ/mol) jauh lebih rendah dari energi ionisasi pertama klorin (1256 kJ/mol). Itu karena dengan menghilangkan satu elektron, natrium dapat memperoleh konfigurasi gas mulia; Oleh karena itu, ia mudah menghilangkan elektron. Selain itu, jarak atom lebih sedikit pada natrium daripada pada klorin, yang menurunkan energi ionisasi. Oleh karena itu, energi ionisasi meningkat dari kiri ke kanan di baris dan bawah ke atas dalam kolom tabel periodik (ini adalah kebalikan dari peningkatan ukuran atom dalam tabel periodik). Saat melepas elektron, ada beberapa contoh di mana atom mendapatkan konfigurasi elektron yang stabil. Pada titik ini, energi ionisasi cenderung melompat ke nilai yang lebih tinggi.
Perbedaan antara elektronegativitas dan energi ionisasi?
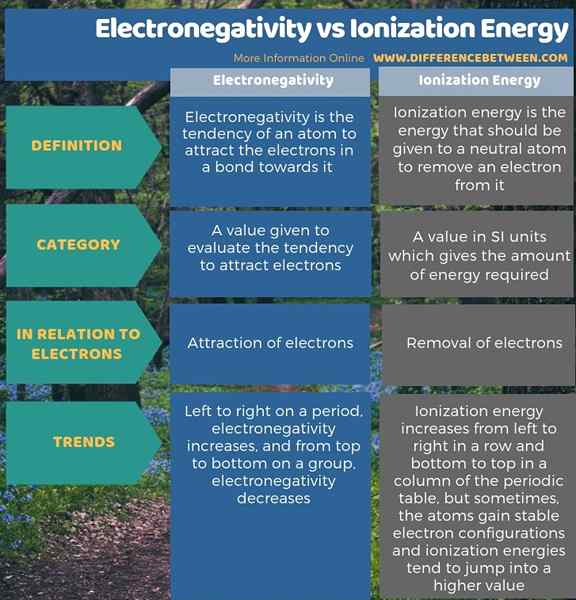
Elektronegativitas adalah kecenderungan atom untuk menarik elektron dalam ikatan ke arahnya sementara energi ionisasi adalah energi yang dibutuhkan atom netral untuk menghilangkan elektron darinya. Oleh karena itu, perbedaan utama antara elektronegativitas dan energi ionisasi adalah bahwa elektronegativitas menjelaskan daya tarik elektron sementara energi ionisasi mengacu pada penghapusan elektron dari atom.
Selain itu, ada perbedaan signifikan antara elektronegativitas dan energi ionisasi berdasarkan tren mereka dalam tabel elemen periodik. Elektronegativitas meningkat dari kiri ke kanan pada periode dan berkurang dari atas ke bawah pada kelompok. Sedangkan, energi ionisasi meningkat dari kiri ke kanan di baris dan bawah ke atas dalam kolom tabel periodik. Namun, kadang -kadang, atom mendapatkan konfigurasi elektron yang stabil, dan dengan demikian, energi ionisasi cenderung melompat ke nilai yang lebih tinggi.
Ringkasan -Elektronegativitas VS Energi Ionisasi
Istilah elektronegativitas dan energi ionisasi menjelaskan interaksi antara inti atom dan elektron. Perbedaan utama antara elektronegativitas dan energi ionisasi adalah bahwa elektronegativitas menjelaskan daya tarik elektron sementara energi ionisasi mengacu pada penghapusan elektron dari atom.
Referensi:
1. Helmenstine, Anne Marie. “Definisi dan contoh elektronegativitas."Thoughtco, OCT. 17, 2018, tersedia di sini.
2. Helmenstine, Anne Marie. “Definisi dan tren energi ionisasi."Thoughtco, Jan. 24, 2019, tersedia di sini.
Gambar milik:
1. "Taula Periòdica Electronegativitat" oleh Joanjoc di Catalan Wikipedia - ditransfer dari CA.Wikipedia ke Commons (domain publik) melalui Commons Wikimedia
2. "Energi ionisasi pertama" oleh sponk (file png) GLRX (file svg) wylve (zh-hans, zh-hant) palosirkka (fi) michel djerzinski (vi) tferenczy (cz) obser (sr-ec, sr-e, hr) , BS, SH) DePIEP (Elemen 104-108) Bob Saint Clar (FR) Shizhao (ZH-HANS) Wiki LIC (ES) Agung Karjono (ID) Szaszicska (HU)-Pekerjaan sendiri berdasarkan: erste ionisierungsenergie kode warna pse pse pse.png oleh sponk (cc by 3.0) Via Commons Wikimedia


