Perbedaan antara langkah dasar dan langkah penentuan tingkat
Itu perbedaan utama Antara langkah dan langkah penentu tingkat dasar adalah itu Langkah -langkah dasar adalah reaksi kimia di mana reaktan bereaksi untuk memberikan produk akhir atau perantara sedangkan langkah penentu laju adalah langkah reaksi paling lambat dari proses multistep.
Istilah Langkah Dasar dan Langkah Penentuan Laju digunakan dalam membahas laju reaksi reaksi kimia, terutama ketika ada dua langkah atau lebih sebelum membentuk produk akhir. Setiap langkah dari proses multistep ini disebut langkah dasar. Langkah -langkah ini memiliki tarif yang berbeda. Langkah penentu laju proses memiliki tingkat paling lambat.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu langkah dasar
3. Apa itu langkah penentu tingkat
4. Perbandingan Berdampingan - Langkah Dasar vs Langkah Penentu Langkah dalam Bentuk Tabel
5. Ringkasan
Apa itu langkah dasar?
Langkah Dasar adalah langkah tunggal yang termasuk dalam proses multistep. Langkah dasar adalah reaksi kimia di mana satu atau dua reaktan bereaksi untuk memberikan produk akhir atau produk perantara. Ini adalah langkah reaksi tunggal, dan memiliki keadaan transisi tunggal. Secara umum, jika tidak ada produk perantara yang diproduksi selama reaksi kimia tertentu, reaksi ini disebut reaksi dasar. Selain itu, mekanisme reaksi kimia adalah kumpulan langkah dasar. Oleh karena itu, reaksi dasar menggambarkan momen tunggal selama reaksi di mana molekul pecah dan/atau membentuk ikatan baru.
Jumlah dari semua langkah dasar yang seimbang memberikan reaksi keseluruhan. Langkah -langkah dasar dari proses multistep memiliki laju reaksi yang berbeda; e.G. Beberapa langkah dasar terjadi dengan cepat sementara langkah -langkah lain sangat lambat. Oleh karena itu, langkah penentu laju atau langkah reaksi paling lambat juga merupakan jenis reaksi dasar.
Reaksi dasar dapat dikategorikan berdasarkan molekulnya. Di sini, jumlah molekul yang terlibat dalam reaksi digunakan untuk memberikan molekuler dari langkah dasar. E.G. Jika ada reaktan tunggal, itu unimolekul, dan jika ada dua reaktan, itu adalah bimolekul. Unimolekul dan bimolekul adalah jenis reaksi dasar yang paling umum. Reaksi Termolekul (Tiga Reaktan) jarang terjadi karena tabrakan tiga molekul pada saat yang sama jarang terjadi.
Apa itu langkah penentu tingkat?
Langkah penentu laju adalah langkah paling lambat dari proses reaksi multistep. Ini adalah satu langkah di antara serangkaian langkah. Namun, beberapa reaksi hanya memiliki satu reaksi kimia (bukan serangkaian reaksi); Dengan demikian, reaksi ini selalu merupakan reaksi penentu laju. Reaksi yang memiliki laju paling lambat diambil sebagai reaksi penentu laju karena membatasi laju reaksi.

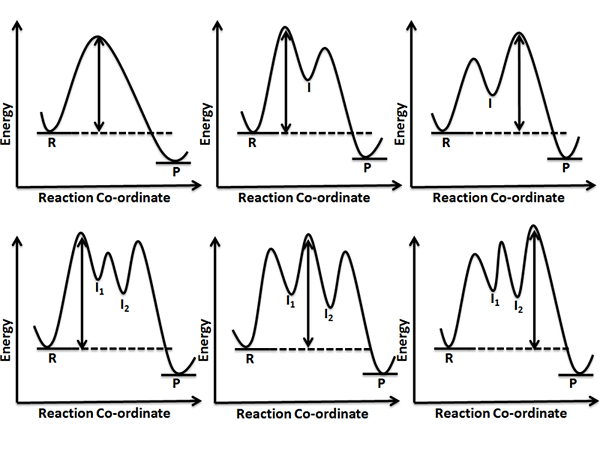
Gambar 01: Panah berkepala dua menunjukkan langkah penentuan laju dari setiap reaksi
Contoh diberikan di bawah ini.
NO2 +NO2 → NO +NO3 (Langkah lambat, penentu tingkat)
NO3+ CO → NO2+ CO2 (Langkah Cepat)
Apa perbedaan antara langkah penentuan langkah dan tingkat dasar?
Perbedaan utama antara langkah penentu langkah dan tingkat dasar adalah bahwa langkah -langkah dasar adalah reaksi kimia di mana reaktan bereaksi untuk memberikan produk akhir atau perantara sedangkan langkah penentu laju adalah langkah reaksi paling lambat dari proses multistep. Oleh karena itu, langkah dasar bisa cepat atau lambat, sedangkan langkah penentu laju selalu merupakan langkah paling lambat.
Di bawah infografis merangkum perbedaan antara langkah dasar dan langkah penentuan laju.
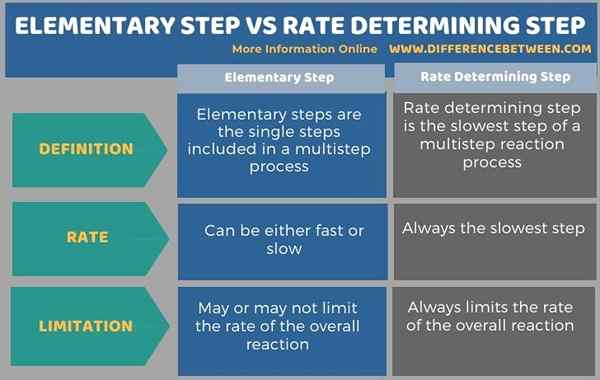
Ringkasan -Langkah Dasar vs Langkah Penentuan Tingkat
Istilah Langkah Dasar dan Langkah Penentuan Laju digunakan dalam membahas laju reaksi reaksi kimia ketika ada dua atau lebih langkah yang terjadi sebelum membentuk produk akhir. Perbedaan utama antara langkah penentu langkah dan tingkat dasar adalah bahwa langkah -langkah dasar adalah reaksi kimia di mana reaktan bereaksi untuk memberikan produk akhir atau perantara sedangkan langkah penentu laju adalah langkah reaksi paling lambat dari proses multistep.
Referensi:
1. “Langkah Dasar.”Kimia Libretexts, Libretexts, 19 Mei 2020, Tersedia Di Sini.
2. “Kimia Tanpa Batas.Lumen, tersedia di sini.
3. “Reaksi Dasar.”Wikipedia, Wikimedia Foundation, 5 September. 2019, tersedia di sini.
Gambar milik:
1. “Diagram Koordinat Reaksi untuk Reaksi dengan 0, 1, 2 Intermediate” oleh Aimnature-Karya Sendiri (CC BY-SA 3.0) Via Commons Wikimedia


