Perbedaan antara endergonik dan eksergonik
Itu perbedaan utama antara endergonik dan eksergonik adalah itu Reaksi endergonik tidak spontan dan tidak menguntungkan, sedangkan reaksi eksergonik spontan dan menguntungkan.
Energi adalah kapasitas untuk melakukan pekerjaan. Dalam suatu sistem, energi dapat melakukan pekerjaan dan energi dapat diubah ke bentuk lain seperti panas, suara, cahaya dll. Ketika energi suatu sistem berubah sebagai akibat dari perbedaan suhu antara sistem dan sekitarnya, kita mengatakan bahwa energi telah ditransfer sebagai panas. Reaksi kimia dapat dianggap sebagai suatu sistem. Reaksi kimia adalah proses di mana satu atau lebih senyawa dikonversi menjadi set senyawa baru melalui serangkaian perubahan.
Saat reaksi berlangsung, mungkin ada transfer energi dari sekitar ke sistem atau sebaliknya. Beberapa reaksi ini spontan, dan beberapa tidak. Semua reaksi yang terjadi di lingkungan tidak spontan, tetapi kita melihat reaksi non-spontan ini terjadi secara alami. Itu karena reaksi non-spontan digabungkan dengan reaksi spontan dan mereka didorong oleh energi reaksi spontan.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu Endergonic
3. Apa itu Exergonic
4. Perbandingan berdampingan - Endergonik vs Exergonic dalam bentuk tabel
5. Ringkasan
Apa itu Endergonic?
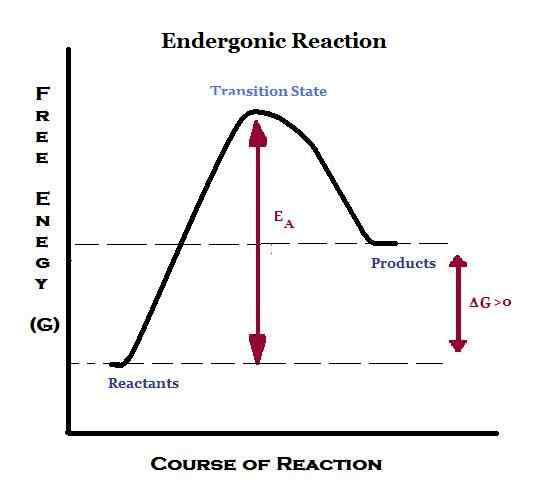
Kata "ender" berasal dari kata "endo" yang berarti "di dalam". Oleh karena itu, endergonik berarti menyerap energi dalam bentuk pekerjaan. Oleh karena itu, dalam reaksi endergonik, sekitarnya memasok energi ke dalam sistem. Selain itu, produk akan memiliki energi yang lebih tinggi daripada reaktan. Reaksi endergonik dianggap tidak kontan atau tidak menguntungkan. Jika transfer energi ini terjadi pada tekanan dan suhu konstan, energi bebas Gibbs standar akan positif. Dengan demikian, konstanta keseimbangan untuk reaksi endergonik kurang dari satu.

Fotosintesis adalah reaksi endergonik yang terjadi di lingkungan alami. Untuk fotosintesis, energi dipasok oleh sinar matahari. Di dalam tubuh manusia, ketika reaksi endergonik terjadi, energi dipasok oleh ATP. Oleh karena itu, reaksi endergonik digabungkan dengan reaksi hidrolisis ATP.
Apa itu Exergonic?
Exergonic berarti melepaskan energi dalam bentuk pekerjaan. Dalam reaksi ini, energi dilepaskan dari sistem ke luar. Reaksi eksergonik menguntungkan dan spontan.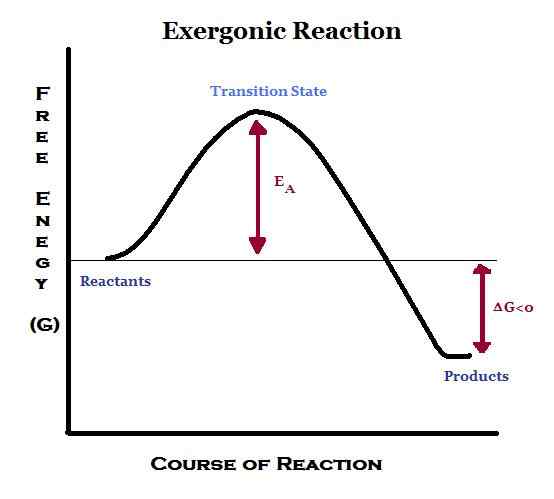
Karena energi dilepaskan selama reaksi, produk mengandung lebih sedikit energi daripada reaktan. Oleh karena itu, perubahan entalpi (∆H) menjadi negatif. Selain itu, jika transfer dilakukan pada tekanan dan suhu konstan, energi bebas Gibbs standar akan menjadi nilai negatif.
Apa perbedaan antara endergonik dan eksergonik?
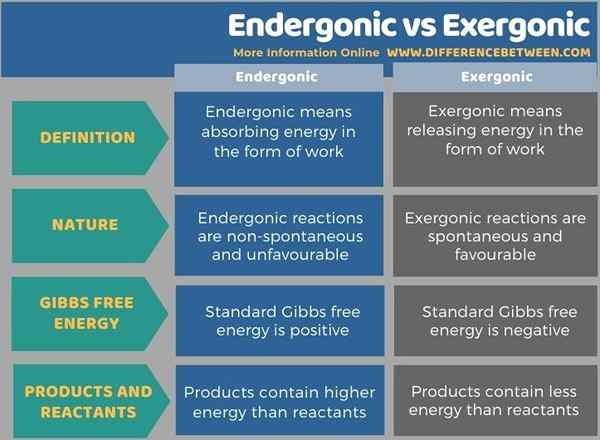
Endergonic berarti menyerap energi dalam bentuk pekerjaan sedangkan eksergonik berarti melepaskan energi dalam bentuk pekerjaan. Perbedaan utama antara endergonik dan eksergonik adalah bahwa reaksi endergonik tidak spontan dan tidak menguntungkan, sedangkan reaksi eksergonik spontan dan menguntungkan. Energi bebas Gibbs standar akan positif dalam reaksi endergonik, berbeda dengan reaksi eksergonik. Dalam reaksi eksergonik, produk mengandung lebih sedikit energi daripada reaktan tetapi, dalam reaksi endergonik, produk mengandung energi yang lebih tinggi daripada reaktan.
Ringkasan -Engergonic vs Exergonic
Endergonic berarti menyerap energi dalam bentuk pekerjaan sedangkan eksergonik berarti melepaskan energi dalam bentuk pekerjaan. Perbedaan utama antara endergonik dan eksergonik adalah bahwa reaksi endergonik tidak spontan dan tidak menguntungkan, sedangkan reaksi eksergonik spontan dan menguntungkan.
Gambar milik:
1. "Endergonic" oleh J3hoang - karya sendiri (CC BY -SA 3.0) Via Commons Wikimedia
2. "Exergonic" oleh J3hoang - karya sendiri (CC BY -SA 3.0) Via Commons Wikimedia


