Perbedaan antara titik akhir dan titik stoikiometrik
Itu perbedaan utama Antara titik akhir dan titik stoikiometrik adalah itu Titik akhir datang tepat setelah titik stoikiometrik, sedangkan titik stoikiometrik adalah titik paling akurat di mana netralisasi selesai.
Titrasi asam-basa melibatkan reaksi netralisasi, yang terjadi pada titik di mana asam bereaksi dengan jumlah basa yang sama secara kimia. Namun, ada sedikit perbedaan antara titik teoritis di mana reaksi tepat berakhir dan titik di mana kita mendeteksinya secara praktis. Selain itu, Anda juga harus mencatat bahwa istilah titik kesetaraan adalah nama yang lebih umum digunakan untuk titik stoikiometrik.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa titik akhir
3. Apa titik stoikiometri
4. Perbandingan berdampingan - titik akhir vs stoikiometri dalam bentuk tabel
5. Ringkasan
Apa titik akhir?
Titik di mana reaksi tampaknya diselesaikan adalah titik akhir dari titrasi. Kita dapat secara eksperimental menentukan poin ini. Mari kita pertimbangkan contoh untuk secara praktis memahami hal ini. Asumsikan kami titrasi 100 ml 0.1 m asam klorida (HCl) dengan 0.5 m natrium hidroksida.
Hcl(aq) + Naoh(aq) ⟶ h2O + NaCl(aq)
Kami menyimpan asam dalam labu titrasi dan titrasi terhadap NaOH di hadapan metil oranye sebagai indikator. Dalam medium asam, indikator tidak berwarna dan menunjukkan warna merah muda di media dasar. Awalnya, hanya ada asam (HCl 0.1 m/100 ml) dalam labu titrasi; pH larutan sama dengan 2. Saat kami menambahkan NaOH, pH larutan meningkat karena netralisasi sejumlah asam dalam medium. Kita harus menambahkan basis terus drop demi drop sampai mencapai penyelesaian. PH reaksi menjadi sama dengan 7 saat reaksi selesai. Bahkan pada titik ini, indikator tidak menunjukkan warna dalam medium karena mengubah warna dalam media dasar.
Untuk mengamati perubahan warna, kita perlu menambahkan satu setetes NaOH lagi, bahkan setelah menyelesaikan netralisasi. PH solusi berubah secara drastis pada titik ini. Inilah titik di mana kami mengamati saat reaksi selesai.
Apa titik stoikiometri?
Titik kesetaraan adalah nama umum untuk titik stoikiometrik. Itu adalah titik di mana asam atau basa melengkapi reaksi netralisasi. Reaksi selesai secara teoritis pada titik ini, tetapi secara praktis kita tidak dapat mengamati titik yang tepat. Lebih baik jika kita dapat menentukan kapan titik yang setara tercapai karena itu adalah titik yang tepat di mana netralisasi telah terjadi. Namun, kita dapat mengamati penyelesaian reaksi di titik akhir.

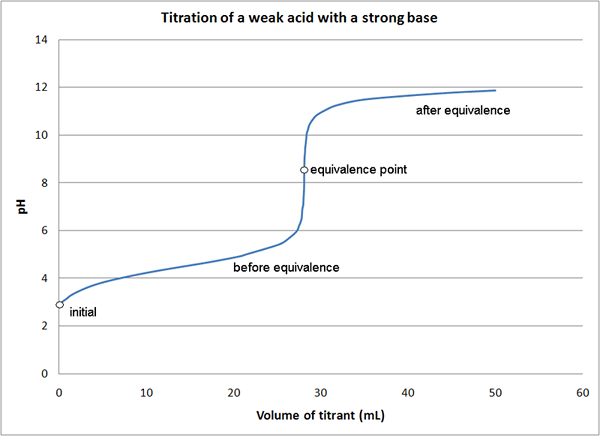
Gambar 01: Grafik untuk titrasi yang menunjukkan titik kesetaraan
Jika kita mempertimbangkan contoh yang sama seperti di atas, pada awal reaksi, kita hanya memiliki asam dalam medium (HCl). Sebelum mencapai titik kesetaraan, dengan penambahan NaOH, kami memiliki asam yang tidak bereaksi dan membentuk garam (HCl dan NaCl). Pada titik kesetaraan, kami hanya memiliki garam di media. Di titik akhir, kami memiliki garam dan alas (NaCl dan NaOH) di medium.
Apa perbedaan antara titik akhir dan titik stoikiometrik?
Titik akhir dan titik stoikiometrik (secara umum, titik kesetaraan) selalu berbeda satu sama lain. Perbedaan utama antara titik akhir dan titik stoikiometrik adalah bahwa titik akhir datang tepat setelah titik stoikiometrik, sedangkan titik stoikiometrik adalah titik paling akurat di mana netralisasi selesai. Selain itu, kita dapat mengamati titik akhir tetapi tidak dapat mengamati titik stoikiometrik secara praktis.

Ringkasan -titik akhir vs stoikiometri
Titik akhir dan titik stoikiometrik (secara umum, titik kesetaraan) selalu berbeda satu sama lain. Perbedaan utama antara titik akhir dan titik stoikiometrik adalah bahwa titik akhir datang tepat setelah titik stoikiometrik, sedangkan titik stoikiometrik adalah titik paling akurat di mana netralisasi selesai.
Referensi:
1. Helmenstine, Anne Marie. “Definisi Titik Kesetaraan."Thoughtco, May. 7, 2019, tersedia di sini.
Gambar milik:
1."Titrasi asam lemah dengan basa kuat" oleh Quantumkinetics - karya sendiri (CC oleh 3.0) Via Commons Wikimedia