Perbedaan antara seri transisi kedua dan ketiga pertama
Itu perbedaan utama Antara seri transisi kedua dan ketiga pertama adalah itu Orbital terluar dari elemen seri transisi pertama adalah 3D sedangkan Seri Transisi Kedua Orbital Paling terluar adalah 4D dan orbital terluar dalam seri transisi ketiga adalah 5D.
Logam transisi adalah elemen kimia yang memiliki orbital yang diisi sebagian. Dalam tabel elemen periodik, ada tiga serangkaian elemen transisi; Kami menamai mereka sebagai seri transisi pertama, kedua dan ketiga. Ini adalah elemen kimia dari tiga periode yang berbeda dalam tabel periodik. Oleh karena itu, mereka mengandung orbital luar yang berbeda.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa seri transisi pertama
3. Apa seri transisi kedua
4. Apa seri transisi ketiga
5. Perbandingan berdampingan - seri transisi pertama vs kedua vs kedua dalam bentuk tabel
6. Ringkasan
Apa seri transisi pertama?
Seri transisi pertama adalah daftar elemen kimia mulai dari skandium hingga tembaga. Kami juga dapat menggambarkannya sebagai logam transisi baris pertama karena ini adalah logam yang termasuk dalam periode pertama blok D, yang berisi logam transisi. Oleh karena itu, ketika mempertimbangkan konfigurasi elektron dari elemen -elemen ini, semua elemen ini memiliki elektron 3D dan 4S. Ini berarti orbital terluar dari elemen -elemen ini adalah orbital 3D. Selain itu, elemen -elemen dari seri ini berisi konfigurasi elektron argon lengkap dengan elektron 3D dan 4S.
Gambar 01: Tabel elemen periodik
Elemen kimia dalam seri transisi pertama
Daftar elemen kimia dalam seri ini adalah sebagai berikut:
- Skandium
- Titanium
- Vanadium
- Kromium
- Mangan
- Besi
- Kobalt
- Nikel
- Tembaga
Apa seri transisi kedua?
Seri transisi kedua adalah daftar elemen kimia mulai dari yttrium hingga perak. Kita dapat menyebutkannya sebagai logam transisi baris kedua juga karena mereka berada di periode kedua blok D dan mereka adalah logam. Konfigurasi elektron dari elemen -elemen ini memiliki orbital 4D dan 5S; Oleh karena itu, orbital D terluar adalah orbital 4D. Selain itu, elemen -elemen dari seri ini berisi konfigurasi elektron Krypton lengkap dengan elektron 4D dan 5S. Anggota daftar ini adalah sebagai berikut:
Elemen kimia dalam seri transisi kedua
- Yttrium
- Zirkonium
- Niobium
- Molybdenum
- Technetium
- Ruthenium
- Rhodium
- Palladium
- Perak
Apa seri transisi ketiga?
Seri transisi ketiga adalah daftar elemen kimia mulai dari hafnium hingga emas, ditambah lanthanum. Ini berada di periode ketiga blok D, dan juga berisi anggota pertama dari seri Lanthanide (lanthanum) juga karena elemen seri transisi ketiga dan lanthanum memiliki orbital elektron 5D dan 6S dalam konfigurasi elektron mereka. Selain itu, elemen -elemen dari seri ini berisi konfigurasi elektron xenon lengkap dengan elektron 5d dan 6s.

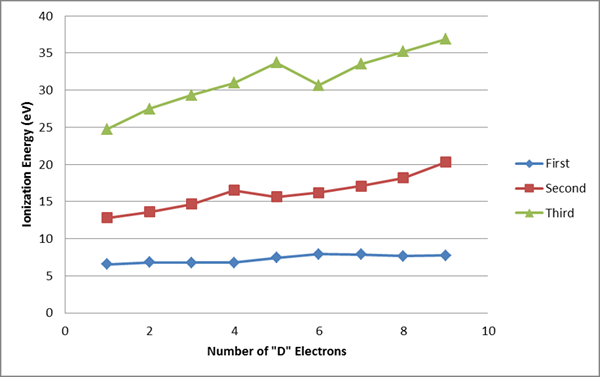
Gambar 02: Energi pengion elemen transisi pertama, kedua dan ketiga
Elemen kimia dalam seri transisi ketiga
- Lanthanum
- Hafnium
- Tantalum
- Tungsten
- Rhenium
- Osmium
- Indium
- Platinum
- Emas
Apa perbedaan antara seri transisi kedua dan ketiga pertama?
Dalam tabel elemen periodik, ada tiga seri elemen transisi yang kami sebutkan sebagai seri transisi pertama, kedua dan ketiga. Perbedaan utama antara seri transisi kedua dan ketiga pertama adalah bahwa orbital D Seri Transisi Pertama adalah 3D sedangkan orbital D kedua dari seri transisi kedua adalah 4D dan orbital terluar dari seri transisi ketiga adalah 5D.
Selain itu, seri transisi pertama adalah daftar elemen kimia mulai dari skandium hingga tembaga. Seri transisi kedua adalah daftar elemen kimia mulai dari yttrium hingga perak, sedangkan seri transisi ketiga adalah daftar elemen kimia mulai dari hafnium hingga emas, ditambah lanthanum. Di antara tiga seri ini, seri transisi kedua dan ketiga memiliki sifat terkait erat, yang sangat berbeda dari sifat -sifat seri transisi pertama.
Selain itu, elemen -elemen dari seri transisi pertama berisi konfigurasi elektron argon lengkap dengan elektron 3D dan 4S. Namun, seri transisi kedua berisi konfigurasi elektron Krypton lengkap dengan elektron 4D dan 5S. Sementara itu, elemen -elemen seri transisi ketiga berisi konfigurasi elektron xenon lengkap dengan elektron 5d dan 6s. Jadi, ini juga perbedaan yang signifikan antara seri transisi kedua dan ketiga pertama.
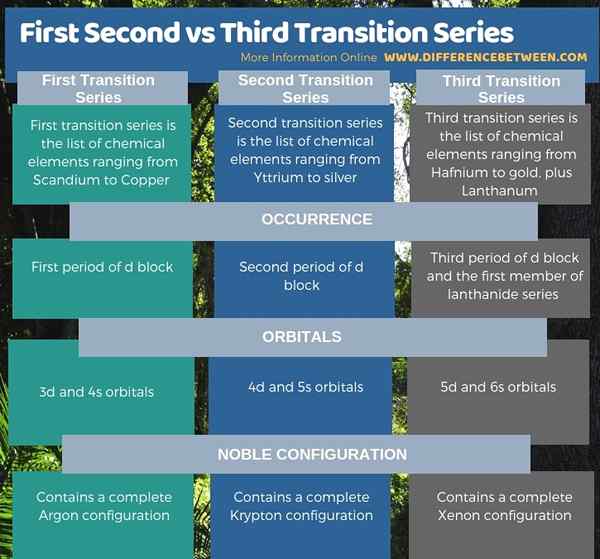
Ringkasan -seri transisi pertama vs kedua vs kedua
Dalam tabel elemen periodik, ada tiga serangkaian elemen transisi; Kami menamai mereka sebagai seri transisi pertama, kedua dan ketiga. Perbedaan utama antara seri transisi kedua dan ketiga pertama adalah bahwa orbital D Seri Transisi Pertama adalah 3D sedangkan orbital D kedua dari seri transisi kedua adalah 4D dan orbital terluar dari seri transisi ketiga adalah 5D.
Referensi:
1. “23.1: Sifat Umum Logam Transisi.”Libretexts Chemistry, Libretexts, 18 September. 2019, tersedia di sini.
2. “Seri Transisi Ketiga (OR) 5D-Series."Sederhananya, tersedia di sini.
Gambar milik:
1. “Transisi Logam Ionisasi Energi” oleh Oncandor - Karya Sendiri (CC BY -SA 4.0) Via Commons Wikimedia
2. “Simple Periodic Table Chart -en” oleh Offnfopt - Pekerjaan Sendiri (Domain Publik) Via Commons Wikimedia


