Perbedaan antara muatan formal dan keadaan oksidasi
Itu perbedaan utama Antara muatan formal dan keadaan oksidasi adalah itu muatan formal adalah muatan atom dalam molekul yang kami hitung dengan asumsi bahwa elektron dalam ikatan kimia dibagi secara merata antara atom sedangkan keadaan oksidasi adalah jumlah elektron yang kehilangan atau mendapatkan atau berbagi dengan atom lain dengan atom lain.
Muatan formal dan keadaan oksidasi adalah istilah yang berbeda meskipun kami biasanya menganggap mereka sama. Muatan formal menentukan jumlah elektron yang terjadi di sekitar atom molekul sementara keadaan oksidasi menentukan jumlah elektron yang dipertukarkan antara atom selama pembentukan molekul.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu muatan formal
3. Apa keadaan oksidasi
4. Perbandingan berdampingan - muatan formal vs keadaan oksidasi dalam bentuk tabel
5. Ringkasan
Apa itu muatan formal?
Muatan formal adalah muatan atom dalam molekul yang kami hitung dengan asumsi bahwa elektron dalam ikatan kimia dibagi secara merata antara atom. Oleh karena itu, ketika menentukan muatan formal, kami membandingkan jumlah elektron di sekitar atom netral dan jumlah elektron di sekitar atom itu ketika berada dalam molekul. Dalam penentuan muatan formal ini, kita harus menetapkan elektron molekul ke atom individu. Di sini, kita perlu mempertimbangkan persyaratan berikut juga;
- Kita harus menetapkan elektron non-orbonding ke atom di mana elektron non-ikatan terjadi
- Kita harus membagi elektron ikatan secara setara antara atom bersama
Hubungan matematika untuk perhitungan ini adalah sebagai berikut:
Muatan formal = (jumlah elektron valensi dalam atom netral) - (jumlah elektron pasangan tunggal) - (1/2*elektron pasangan ikatan)
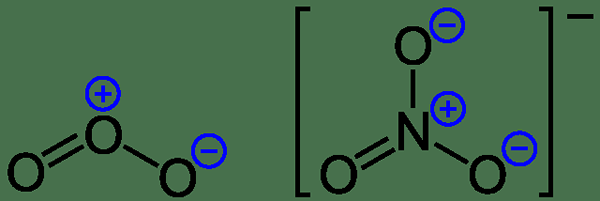
Gambar 1: Biaya formal pada ozon dan anion nitrat
Mari kita pertimbangkan contoh untuk memahami fenomena ini. Untuk molekul amonia, ada tiga ikatan N-H dan pasangan elektron tunggal pada atom nitrogen. Kemudian kapan dapat menghitung berikut;
Biaya formal n = 5 - 2 - 1/2*6 = 0
Biaya formal h = 1 - 0 - 1/2*2 = 0
Apa keadaan oksidasi?
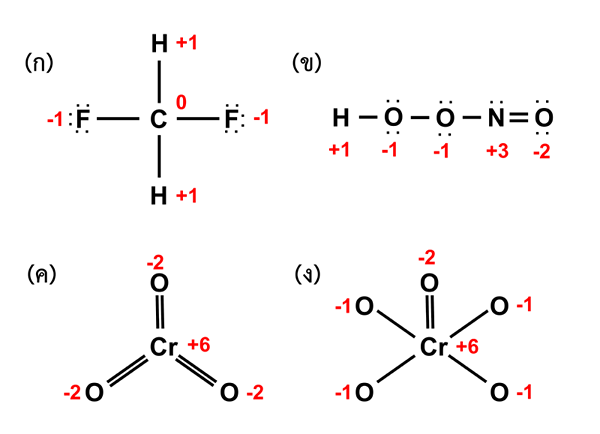
Keadaan oksidasi adalah jumlah elektron yang dapat kehilangan, mendapatkan atau berbagi atau berbagi dengan atom lain dengan atom lain. Istilah ini diterapkan pada elemen kimia apa pun dalam molekul (istilah nomor oksidasi diterapkan terutama pada atom logam sentral dari kompleks koordinasi meskipun kami menggunakan istilah ini secara bergantian). Keadaan oksidasi sebenarnya memberikan tingkat oksidasi atom dalam suatu senyawa. Kita harus selalu memberikan keadaan oksidasi sebagai bilangan bulat, dan diwakili dalam angka Hindu-Arab, termasuk muatan atom. Misalnya, keadaan oksidasi zat besi di feo adalah +2.

Gambar 02: Status oksidasi atom dalam molekul yang berbeda
Tips untuk penentuan keadaan oksidasi:
- Keadaan oksidasi dari satu elemen adalah nol (ini termasuk molekul yang terbuat dari satu elemen tunggal).
- Total muatan molekul atau ion adalah jumlah muatan masing -masing atom.
- Keadaan oksidasi logam alkali selalu +1, dan untuk logam tanah alkali itu +2.
- Sementara itu, keadaan oksidasi fluor selalu -1.
- Selanjutnya, keadaan oksidasi hidrogen biasanya +1. Tapi terkadang itu -1 (bila terikat pada logam alkali atau alkali bumi.)
- Juga, secara umum, keadaan oksidasi oksigen adalah -2 (tetapi dalam peroksida dan super -oksida dapat bervariasi).
- Atom paling elektronegatif dalam molekul mendapatkan muatan negatif, dan yang lainnya mendapatkan muatan positif.
Keadaan oksidasi sangat berguna untuk penentuan produk dalam reaksi redoks. Reaksi redoks adalah reaksi kimia yang mencakup pertukaran elektron antara atom. Dalam reaksi redoks, dua reaksi setengah terjadi secara paralel secara bersamaan. Salah satunya adalah reaksi oksidasi, dan yang lainnya adalah reaksi reduksi. Reaksi oksidasi melibatkan peningkatan keadaan oksidasi atom, sedangkan reaksi reduksi melibatkan penurunan keadaan oksidasi atom.
Apa perbedaan antara muatan formal dan keadaan oksidasi?
Perbedaan utama antara muatan formal dan keadaan oksidasi adalah bahwa muatan formal adalah muatan atom dalam molekul yang kami hitung dengan asumsi bahwa elektron dalam ikatan kimia dibagi secara merata antara atom sedangkan keadaan oksidasi adalah jumlah elektron yang kehilangan atom atau mendapatkan perolehan atau berbagi dengan atom lain. Misalnya, muatan formal atom nitrogen dalam molekul amonia adalah 0, sedangkan keadaan oksidasi adalah +3.
Di bawah infografis merangkum perbedaan antara muatan formal dan keadaan oksidasi.

Ringkasan -muatan formal vs oksidasi
Muatan formal dan keadaan oksidasi adalah istilah yang berbeda meskipun beberapa orang menganggap mereka sama. Perbedaan utama antara muatan formal dan keadaan oksidasi adalah bahwa muatan formal adalah muatan atom dalam molekul yang kami hitung dengan asumsi bahwa elektron dalam ikatan kimia dibagi secara merata antara atom sedangkan keadaan oksidasi adalah jumlah elektron yang kehilangan atom atau mendapatkan perolehan atau berbagi dengan atom lain.
Referensi:
1. “2.3: Biaya formal." Libreteks Kimia, Libretexts, 25 Juli 2019, tersedia di sini.
Gambar milik:
1. “Prinsip Biaya Formal V.1 ”oleh Jü - karya sendiri (domain publik) melalui Commons Wikimedia
2. “Tugas Negara Oksidasi” oleh Saranphong Yimklan - Pekerjaan Sendiri (Domain Publik) melalui Commons Wikimedia


