Perbedaan antara radikal bebas dan spesies oksigen reaktif
Itu perbedaan utama Antara radikal bebas dan spesies oksigen reaktif adalah itu Radikal bebas mungkin atau tidak mengandung atom oksigen, sedangkan spesies oksigen reaktif pada dasarnya mengandung atom oksigen.
Kami biasanya menggunakan istilah radikal bebas dan spesies oksigen reaktif secara bergantian karena spesies oksigen reaktif selalu merupakan senyawa radikal bebas. Namun, tidak semua radikal bebas adalah spesies oksigen reaktif; Mereka mungkin atau mungkin tidak mengandung atom oksigen, tetapi mereka sangat reaktif karena adanya elektron yang tidak berpasangan. Oleh karena itu kedua bentuk ini cenderung bereaksi dengan sumber yang sesuai untuk mendapatkan elektron untuk berpasangan dengan elektron tidak berpasangan sehingga konfigurasi elektron menjadi stabil.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu radikal bebas
3. Apa itu spesies oksigen reaktif
4. Perbandingan berdampingan - spesies oksigen oksigen vs molekuler dalam bentuk tabel
5. Ringkasan
Apa itu radikal bebas?
Radikal bebas adalah atom reaktif atau kelompok atom yang mengandung satu atau lebih elektron yang tidak berpasangan. Mereka sangat reaktif karena adanya elektron yang tidak berpasangan. Selain itu, radikal bebas sangat tidak stabil, dan cenderung stabil melalui mendapatkan elektron dari luar untuk mengisi orbital kosong. Mereka bereaksi dengan senyawa kimia lainnya untuk menangkap elektron yang dibutuhkan. Radikal bebas adalah perantara penting dalam proses alami. Kita dapat menunjukkan radikal bebas dengan titik superskrip di sebelah kanan. Misalnya, h., Cl., Ho., H3C.
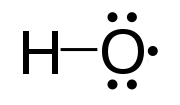
Gambar 01: Radikal Hidroksil
Radikal bebas berumur panjang ada dalam tiga kategori: radikal yang stabil, radikal persisten, dan di-radikal.
- Radikal yang stabil: Contoh utama radikal yang stabil adalah oksigen molekuler o2. Radikal organik yang mengandung sistem π terkonjugasi dapat lama hidup.
- Radikal persisten: mereka berumur panjang karena crowding sterik di sekitar pusat radikal dan membuat mereka sulit bereaksi secara fisik dengan molekul lain.
- Di-radikal: Beberapa molekul memiliki dua pusat radikal; Kami menyebutkannya sebagai di-radikal. Oksigen molekuler secara alami (oksigen atmosfer) ada sebagai diradikal.
Apa itu spesies oksigen reaktif
Spesies oksigen reaktif adalah radikal yang sangat reaktif dan mengandung elektron yang tidak berpasangan. Denotasi untuk istilah ini adalah ROS. Spesies kimia ini pada dasarnya mengandung atom oksigen yang mengandung elektron yang tidak berpasangan. Beberapa contoh umum termasuk peroksida, superoksida, radikal hidroksil, oksigen alfa, dll.

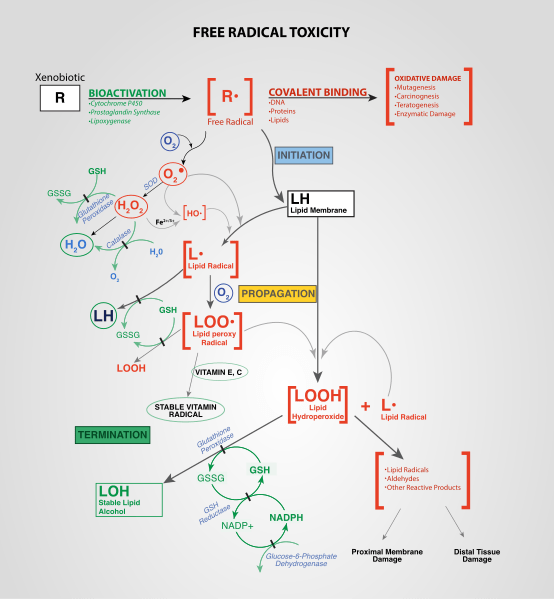
Gambar 02: Pembentukan ROS secara endogen
Reaksi kimia yang berbeda membentuk spesies oksigen reaktif ini; Sebagai contoh, reduksi oksigen molekuler membentuk superoksida dan spesies oksigen reaktif ini bertindak sebagai prekursor untuk banyak formasi radikal lainnya. Peroksida adalah tipe ROS penting lainnya yang terbentuk dari pemecatan superoksida.
Ada jalur endogen dan eksogen untuk memproduksi ROS. Misalnya, spesies oksigen reaktif terbentuk dalam berbagai reaksi biologis dalam sel dan organel seperti peroksisom. Produksi ROS eksogen mengacu pada pembentukan spesies oksigen reaktif karena pengaruh agen eksternal seperti polutan, logam berat, asap, obat -obatan, dll.
Apa perbedaan antara radikal bebas dan spesies oksigen reaktif?
Kami biasanya menggunakan istilah radikal bebas dan spesies oksigen reaktif secara bergantian karena spesies oksigen reaktif selalu merupakan senyawa radikal bebas. Namun, tidak semua radikal bebas adalah spesies oksigen reaktif. Perbedaan utama antara radikal bebas dan spesies oksigen reaktif adalah bahwa radikal bebas mungkin atau mungkin tidak mengandung atom oksigen, sedangkan spesies oksigen reaktif pada dasarnya mengandung atom oksigen.
Di bawah ini adalah ringkasan perbedaan antara radikal bebas dan spesies oksigen reaktif.

Ringkasan -Radikal bebas vs spesies oksigen reaktif
Radikal bebas adalah atom reaktif atau kelompok atom yang mengandung satu atau lebih elektron tidak berpasangan, sedangkan spesies oksigen reaktif adalah radikal yang sangat reaktif dan mengandung elektron tidak berpasangan. Perbedaan utama antara radikal bebas dan spesies oksigen reaktif adalah bahwa radikal bebas mungkin atau mungkin tidak mengandung atom oksigen, sedangkan spesies oksigen reaktif pada dasarnya mengandung atom oksigen.
Referensi:
1.“Spesies oksigen reaktif.”Wikipedia, Wikimedia Foundation, 4 Nov. 2019, tersedia di sini.
2. “Apa itu radikal bebas?”Phytochemicals, tersedia di sini.
3. “Radikal (Kimia).”Wikipedia, Wikimedia Foundation, 27 Nov. 2019, tersedia di sini.
Gambar milik:
1. "Hydroxyl Radical" oleh Smokeyjoe - karya sendiri (CC BY -SA 4.0) Via Commons Wikimedia
2. “Toksisitas Radikal Bebas” oleh Dan Cojocari - Pekerja Sendiri (CC BY -SA 4.0) Via Commons Wikimedia


