Perbedaan antara logam grup 1 dan logam transisi
Itu perbedaan utama Antara logam grup 1 dan logam transisi adalah itu Kelompok 1 logam membentuk senyawa tidak berwarna, sedangkan logam transisi membentuk senyawa berwarna -warni.
Logam Grup 1 juga dikenal sebagai logam alkali karena elemen -elemen ini dapat membentuk senyawa alkali. Namun, kelompok 1 dari tabel periodik mengandung hidrogen, yang merupakan non -logam. Logam transisi, di sisi lain, adalah elemen blok D, tetapi tidak semua elemen blok D adalah logam transisi. Kelompok 1 Logam dan Logam Transisi serupa pada kenyataan bahwa keduanya memiliki elektron yang tidak berpasangan.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu Logam Grup 1
3. Apa itu logam transisi
4. Perbandingan Berdampingan - Kelompok 1 Logam vs Transisi Logam Dalam Bentuk Tabel
5. Ringkasan
Apa itu Logam Grup 1?
Kelompok 1 Logam adalah elemen kimia yang memiliki elektron tidak berpasangan di orbital S terluar. Logam ini dinamai logam alkali karena mereka membentuk senyawa kimia yang alkali ketika dilarutkan dalam air. Kita dapat mengamati elemen -elemen ini di kolom pertama blok S dari tabel periodik. Anggota logam Grup 1 ini adalah sebagai berikut:
- Lithium (Li)
- Sodium (NA)
- Kalium (k)
- Rubidium (RH)
- Cesium (CS)
- Francium (FR)
Grup 1 Logam semuanya mengkilap, sangat reaktif, dan sangat lembut (kita dapat dengan mudah memotongnya menggunakan pisau sederhana). Secara umum, logam dalam kelompok ini menunjukkan kepadatan rendah, titik leleh rendah, titik didih rendah dan memiliki struktur kristal kubik yang berpusat pada tubuh. Selain itu, mereka memiliki warna api yang berbeda, sehingga kami dapat dengan mudah membedakannya dengan mengekspos sampel ke pembakar bunsen.
Selain itu, ada beberapa variasi periodik di antara logam Grup 1. Misalnya, ketika turun kelompok, ukuran atom elemen meningkat, titik leleh dan titik didih menurun, kepadatan meningkat, energi ionisasi pertama meningkat, reaktivitas menurun, dll.
Apa itu logam transisi?
Logam transisi adalah elemen kimia yang memiliki atom dengan elektron D yang tidak berpasangan. Dalam elemen -elemen ini, setidaknya kation stabil yang mereka bentuk seharusnya memiliki elektron D yang tidak berpasangan. Dengan demikian, sebagian besar elemen blok D adalah logam transisi. Kami tidak dapat menganggap skandium dan seng sebagai logam transisi karena mereka tidak memiliki elektron yang tidak berpasangan bahkan di kation yang stabil. Atom -atom ini memiliki elektron D, tetapi semuanya adalah elektron berpasangan.

Selain itu, elemen logam transisi dapat membentuk senyawa yang berbeda dengan berbagai warna. Elemen -elemen ini mendapatkan kemampuan ini karena fakta bahwa elemen -elemen ini dapat memiliki keadaan oksidasi yang berbeda yang sangat berwarna. Keadaan oksidasi yang berbeda dari elemen kimia ini dapat memiliki warna yang berbeda. Selain itu, warna-warna ini muncul karena transisi elektronik D-D. Selain itu, karena adanya elektron yang tidak berpasangan ini, logam ini baik paramagnetik atau feromagnetik. Hampir semua elemen ini dapat terikat dengan ligan untuk membentuk kompleks koordinasi.
Apa perbedaan antara logam grup 1 dan logam transisi?
Kelompok 1 logam dan logam transisi berbeda satu sama lain, terutama berdasarkan warna senyawa kimia yang mereka bentuk. Itu adalah; Perbedaan utama antara logam grup 1 dan logam transisi adalah bahwa logam grup 1 membentuk senyawa tidak berwarna, sedangkan logam transisi membentuk senyawa berwarna -warni.
Selain itu, logam Grup 1 adalah elemen kimia yang memiliki elektron tidak berpasangan di orbital S terluar sedangkan logam transisi adalah elemen kimia yang memiliki atom dengan elektron D tidak berpasangan.
Di bawah ini Infografis Tabulasi Perbedaan Antara Logam Grup 1 dan Logam Transisi Lebih Detail.
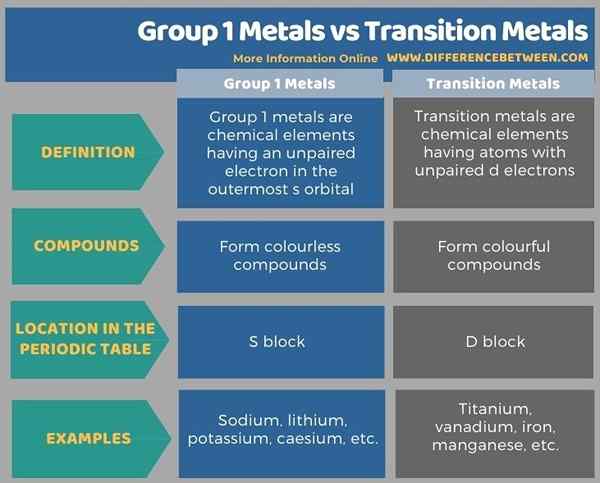
Ringkasan -Kelompok 1 Logam vs Transisi Logam
Kelompok 1 logam dan logam transisi berbeda satu sama lain, terutama berdasarkan warna senyawa kimia yang mereka bentuk. Perbedaan utama antara logam grup 1 dan logam transisi adalah bahwa logam grup 1 membentuk senyawa tidak berwarna, sedangkan logam transisi membentuk senyawa berwarna -warni.
Referensi:
1. Kapas, f. Albert. “Logam transisi.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 3 Apr. 2019, tersedia di sini.
Gambar milik:
1. “Bagan Tabel Berkala dengan Nonmetal Reaktif” oleh SandBH - Karya Sendiri (CC BY -SA 4.0) Via Commons Wikimedia
2. Oleh Benjah-BMM27 diasumsikan (berdasarkan klaim hak cipta). - Pekerjaan sendiri diasumsikan (berdasarkan klaim hak cipta)., (Domain publik) via commons wikimedia


