Perbedaan antara hiperkonjugasi dan efek induktif
Itu perbedaan utama Antara hiperkonjugasi dan efek induktif adalah itu Hyperconjugation menjelaskan interaksi antara ikatan sigma dan ikatan PI sedangkan efek induktif menjelaskan transmisi muatan listrik melalui rantai atom.
Kedua istilah hiperkonjugasi dan efek induktif adalah efek elektronik pada senyawa organik yang mengarah pada stabilisasi senyawa.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu hyperconjugation
3. Apa efek induktif
4. Perbandingan Berdampingan - Hyperconjugation vs Efek Induktif Dalam Bentuk Tabel
5. Ringkasan
Apa itu hyperconjugation?
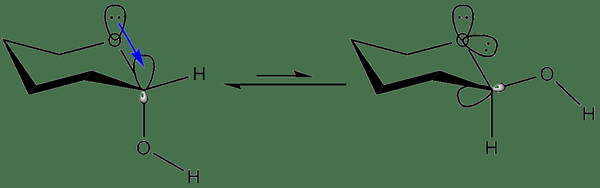
Hyperconjugation adalah interaksi dari σ-ikatan dengan jaringan obligasi PI. Dalam konsep ini, kami mengatakan elektron dalam ikatan sigma menjalani interaksi dengan orbital p yang berdekatan (atau sepenuhnya), atau dengan orbital pi. Proses ini terjadi untuk meningkatkan stabilitas molekul.

Gambar 01: Contoh proses hiperkonjugasi
Penyebab untuk hiperkonjugasi adalah tumpang tindih dari elektron ikatan dalam ikatan sigma C-H dengan orbital P atau orbital pi dari atom karbon yang berdekatan. Di sini, atom hidrogen berada dalam jarak dekat sebagai proton. Muatan negatif yang berkembang pada atom karbon mengalami delokalisasi karena tumpang tindih orbital p atau pi orbital. Selain itu, ada beberapa efek hiperkonjugasi pada sifat kimia senyawa. Saya.e. Dalam karbokasi, hiperkonjugasi menyebabkan muatan positif pada atom karbon.
Apa efek induktif?
Efek induktif adalah efek yang disebabkan oleh transmisi muatan listrik di seluruh rantai atom. Transmisi muatan ini akhirnya mengarah ke muatan listrik tetap pada atom. Efek ini terjadi karena perbedaan dalam nilai elektronegatif atom molekul.
Atom dengan elektronegativitas yang lebih tinggi cenderung menarik elektron ke arah diri mereka sendiri daripada atom elektronegatif yang lebih rendah. Oleh karena itu, ketika atom yang sangat elektronegatif dan atom elektronegatif yang rendah berada dalam ikatan kovalen, elektron ikatan tertarik pada atom yang sangat elektronegatif. Ini menginduksi atom elektronegatif yang rendah untuk mendapatkan muatan positif sebagian. Atom yang sangat elektronegatif akan mendapatkan muatan negatif parsial. Kami menyebut polarisasi ikatan ini.
Efek induktif terjadi dalam dua cara sebagai berikut.
Elektron Melepaskan
Efek ini terlihat ketika kelompok seperti kelompok alkil melekat pada molekul. Kelompok-kelompok ini kurang menarik elektron dan cenderung memberikan elektron ke seluruh molekul.
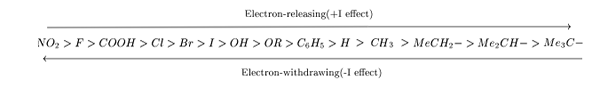
Menarik elektron
Ini muncul ketika atom yang sangat elektronegatif atau kelompok melekat pada molekul. Atom atau kelompok ini akan menarik elektron dari sisa molekul.
Selain itu, efek induktif memiliki efek langsung pada stabilitas molekul, terutama molekul organik. Jika atom karbon memiliki muatan positif parsial, kelompok pelepas elektron seperti kelompok alkil dapat mengurangi atau menghapus muatan positif parsial ini dengan menyediakan elektron. Maka stabilitas molekul itu meningkat.
Apa perbedaan antara hiperkonjugasi dan efek induktif?
Perbedaan utama antara hiperkonjugasi dan efek induktif adalah bahwa hiperkonjugasi menjelaskan interaksi antara ikatan sigma dan ikatan PI sedangkan efek induktif menjelaskan penularan muatan listrik melalui rantai atom. Hyperconjugation menstabilkan molekul melalui delokalisasi pi-elektron sementara efek induktif menstabilkan molekul melalui transmisi muatan listrik melalui molekul.

Ringkasan -Hyperconjugation vs Efek Induktif
Perbedaan utama antara hiperkonjugasi dan efek induktif adalah bahwa hiperkonjugasi menjelaskan interaksi antara ikatan sigma dan ikatan PI sedangkan efek induktif menjelaskan penularan muatan listrik melalui rantai atom.
Referensi:
1. Helmenstine, Anne Marie. “Efek & Resonansi Induktif."Thoughtco, Jul. 3, 2019, Thoughtco.com/definisi-induktif-efek-605241.
Gambar milik:
1. "Thpoh-Hyperconjugation" oleh pengguna Inggris Wikipedia DMacks (CC BY-SA 3.0) Via Commons Wikimedia
2. "Tren Efek Induktif" oleh Manishearth di Wikipedia Bahasa Inggris (CC BY-SA 3.0) Via Commons Wikimedia


