Perbedaan antara reaksi endotermik dan eksotermik
Itu perbedaan utama Antara reaksi endotermik dan eksotermik adalah itu Reaksi endotermik menyerap energi dari lingkungan sekitarnya, sedangkan reaksi eksotermik melepaskan energi ke lingkungan sekitarnya.
Energi adalah kapasitas untuk melakukan pekerjaan. Dalam suatu sistem, energi dapat melakukan pekerjaan; itu dapat berubah menjadi bentuk lain seperti panas, suara, cahaya dll. Ketika energi suatu sistem berubah sebagai akibat dari perbedaan suhu antara sistem dan sekitarnya, kita mengatakan bahwa energi telah ditransfer sebagai panas. Reaksi endotermik adalah proses di mana energi diperoleh dari sekitarnya ke sistem, sedangkan reaksi eksotermik adalah proses yang melepaskan energi dari sistem ke sekitarnya.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa reaksi endotermik
3. Apa reaksi eksotermik
4. Perbandingan berdampingan - reaksi endotermik vs eksotermik dalam bentuk tabel
5. Ringkasan
Apa reaksi endotermik?
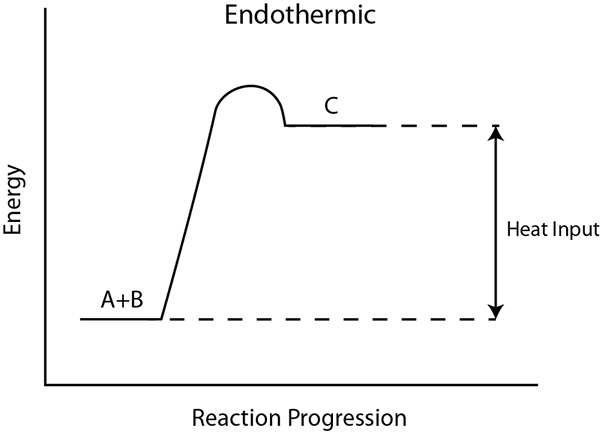
Reaksi endotermik adalah proses di mana energi diperoleh dari lingkungannya, dalam bentuk panas. Jika sekitarnya tidak memasok panas, reaksinya tidak terjadi. Selama reaksi ini, pembuluh reaksi menjadi dingin karena menyerap panas dari lingkungan sekitarnya, sehingga menurunkan suhu.
Untuk mematahkan ikatan kimia, itu membutuhkan energi. Dalam reaksi endotermik, energi reaktan pemecahan ikatan lebih tinggi dari total energi pembentukan ikatan produk. Oleh karena itu, perubahan entalpi adalah nilai positif, dan reaksinya tidak spontan. Oleh karena itu, untuk reaksi endotermik, kita harus memasok energi dari luar.

Misalnya, saat melarutkan amonium klorida dalam air, gelas kedinginan karena larutan menyerap energi dari lingkungan luar. Fotosintesis adalah reaksi endotermik yang terjadi di lingkungan alam. Untuk fotosintesis, sinar matahari memasok energi yang diperlukan.
Apa reaksi eksotermik?
Reaksi eksotermik adalah proses yang melepaskan energi ke lingkungan, biasanya dalam bentuk panas. Selain itu, energi juga dapat dirilis dalam bentuk lain seperti suara, cahaya dll. Karena energi dilepaskan selama reaksi, produk mengandung lebih sedikit energi daripada reaktan. Oleh karena itu, perubahan entalpi (∆H) menjadi negatif.
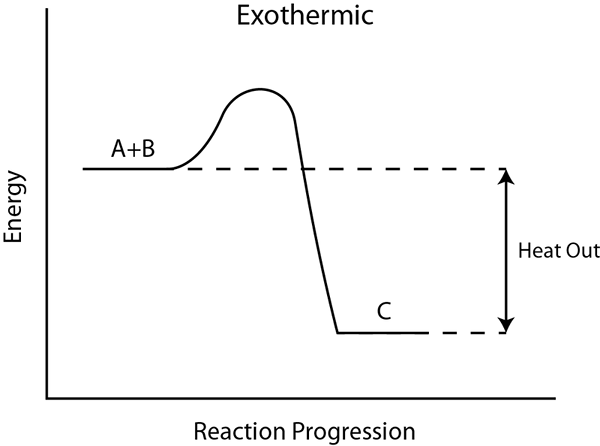
Dalam jenis reaksi ini, rilis energi selama pembentukan ikatan. Jika total energi pembentukan ikatan lebih tinggi dari energi pemecahan ikatan selama reaksi, maka itu adalah eksotermik. Jika energi dilepaskan sebagai panas, suhu di sekitarnya naik, jadi reaksinya terkadang bisa menjadi eksplosif. Reaksi eksotermik spontan. Pasokan energi luar tidak diperlukan untuk reaksi eksotermik karena mereka menghasilkan energi yang dibutuhkan saat reaksi berlangsung. Namun, untuk memulai reaksi, pasokan energi awal mungkin diperlukan.
Jika kita dapat menangkap energi yang dilepaskan ini, kita dapat menggunakannya untuk banyak pekerjaan yang berguna. Misalnya, energi yang dilepaskan dari pembakaran bahan bakar berguna dalam mengoperasikan kendaraan atau mesin. Selain itu, semua reaksi pembakaran bersifat eksotermik.
Apa perbedaan antara reaksi endotermik dan eksotermik?
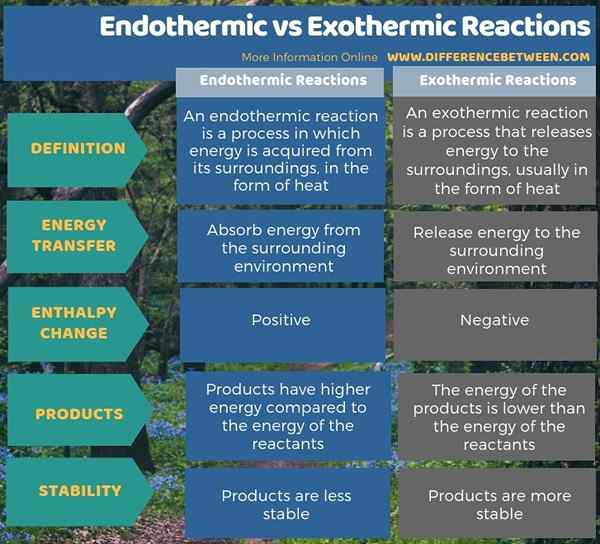
Endotermik dan eksotermik adalah istilah yang terkait dengan perpindahan panas dalam sistem termodinamika. Perbedaan utama antara reaksi endotermik dan eksotermik adalah bahwa reaksi endotermik menyerap energi dari lingkungan sekitarnya, sedangkan reaksi eksotermik melepaskan energi ke lingkungan sekitarnya. Selain itu, perubahan entalpi dalam proses endotermik adalah positif sementara perubahan entalpi dalam proses eksotermik adalah negatif. Saat mempertimbangkan produk akhir, produk reaksi endotermik memiliki energi yang lebih tinggi dibandingkan dengan energi reaktan sedangkan, dalam reaksi eksotermik, produk memiliki energi yang lebih rendah daripada energi reaktan.
Ringkasan -Reaksi Endotermik vs Eksotermik
Endotermik dan eksotermik adalah istilah yang terkait dengan perpindahan panas dalam sistem termodinamika. Perbedaan utama antara reaksi endotermik dan eksotermik adalah bahwa reaksi endotermik menyerap energi dari lingkungan sekitarnya, sedangkan reaksi eksotermik melepaskan energi ke lingkungan sekitarnya.
Referensi:
Helmenstine, Anne Marie. “Contoh reaksi endotermik."Thoughtco, May. 9, 2019, tersedia di sini.
Gambar milik:
1. "Reaksi Endotermik" oleh Brazosport College - karya sendiri (CC BY -SA 3.0) Via Commons Wikimedia
2. "Reaksi Eksotermik" oleh Brazosport College - karya sendiri (CC BY -SA 3.0) Via Commons Wikimedia


