Perbedaan antara ion dan elektron
Ion vs elektron
Ada banyak perbedaan antara elektron dan ion; Ukuran, muatan, dan alam adalah beberapa dari mereka. Elektron adalah partikel mikro bermuatan negatif dan ion adalah molekul atau atom bermuatan negatif atau positif. Sifat elektron dijelaskan dengan menggunakan “mekanika kuantum.”Tetapi sifat -sifat ion dapat dijelaskan dengan menggunakan kimia umum. Elektron (simbol: β- atau ℮-) adalah partikel sub-atom, dan tidak memiliki sub-partikel atau sub-struktur. Tapi, ion dapat memiliki struktur yang lebih kompleks dengan sub-komponen.
Apa itu elektron?
Elektron pertama kali ditemukan oleh j.J. Thompson pada tahun 1906 saat dia bekerja dengan sinar katoda yang disebut balok elektron. Dia menemukan bahwa elektron adalah partikel mikro bermuatan negatif. Dia biasa memanggil mereka "sel lainnya."Selain itu, ia menemukan bahwa elektron adalah elemen atom dan lebih dari 1000 kali lebih kecil dari atom hidrogen. Ukuran elektron adalah sekitar 1/1836 proton.
Menurut teori Bohr, elektron orbit di sekitar nukleus. Tetapi kemudian, sebagai hasil dari percobaan ilmiah, ditemukan bahwa elektron berperilaku lebih seperti gelombang elektromagnetik daripada mengorbit partikel.

Apa itu ion?
Seperti yang dikatakan sebelumnya, ion juga molekul atau atom bermuatan negatif atau positif. Baik atom dan molekul dapat membentuk ion dengan menerima atau menghilangkan elektron. Mereka mendapatkan biaya positif (k+, Ca2+, Al3+) dengan menghapus elektron Dan Dapatkan muatan negatif (CL-, S2-, Alo3-) dengan menerima elektron. Saat ion terbentuk, jumlah elektron tidak sama dengan jumlah proton. Namun, itu tidak mengubah jumlah proton dalam atom/molekul. Keuntungan atau kehilangan satu atau lebih elektron memiliki efek yang signifikan pada sifat fisik dan kimia atom/molekul orang tua.
Apa perbedaan antara elektron dan ion?
• Muatan Listrik:
• Elektron dianggap sebagai partikel dasar bermuatan negatif tetapi bisa positif atau negatif.
• Ion dengan muatan positif disebut "ion positif" dan ion yang sama dengan muatan negatif disebut "ion negatif.”Ion dibentuk dengan menerima atau menyumbangkan elektron.
- Contoh ion positif: NA+, Ca2+, Al3+, Pb4+, NH4+
- Contoh ion negatif: CL-, S2-, Alo3-
• Ukuran:
• Elektron adalah partikel yang sangat kecil dibandingkan dengan ion.
• Ukuran ion bervariasi tergantung pada beberapa faktor.
• Ukuran elektron adalah nilai tetap; itu sekitar 1/1836 proton.
• Struktur atom:
• Elektron bukan polyatomic atau monatomik. Elektron tidak bergabung satu sama lain untuk membentuk senyawa.
• ion dapat berupa polyatomic atau monatomik; Ion monatomik hanya mengandung satu atom sedangkan ion polyatomik mengandung lebih dari satu atom.
- Ion Monatomik: NA+, Ca2+, Al3+, Pb4+
- Ion polyatomic: CLO3-, JADI43-
• Partikel:
• Elektron adalah partikel mikro dan memiliki sifat gelombang-partikel (dualitas gelombang-partikel).
• Ion dianggap sebagai partikel saja.
• Elemen:
• Elektron dianggap sebagai partikel unsur. Dengan kata lain, elektron tidak dapat dibagi menjadi komponen atau substruktur yang lebih kecil.
• Semua ion memiliki sub-komponen. Misalnya, ion polyatomic mengandung berbagai atom; Atom dapat dibagi lagi menjadi neutron, proton, elektron, dll.
• Properti:
• Semua elektron memiliki sifat partikel gelombang yang sama, yang dapat dijelaskan menggunakan mekanika kuantum.
• Sifat kimia dan fisik ion bervariasi dari ion ke ion. Dengan kata lain, ion yang berbeda memiliki sifat kimia dan fisik yang berbeda.
Gambar milik:
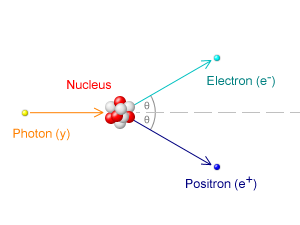
- Pair Produksi oleh Davidhorman (CC BY-SA 3.0)
- Peta potensial elektrostatik dari ion nitrat (NO3−) melalui Wikicommons (domain publik)