Perbedaan antara proses isobarik dan isokorik
Itu perbedaan utama Antara proses isobarik dan isokorik adalah bahwa Proses isobarik terjadi pada tekanan konstan sedangkan proses isokorik terjadi pada volume konstan.
Proses termodinamika adalah proses kimia atau fisik yang terjadi dalam sistem termodinamika, yang mengubah sistem dari keadaan awal ke keadaan akhir. Ada berbagai bentuk proses termodinamika. Proses isobarik dan isokorik adalah dua proses seperti itu.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa proses isobarik
3. Apa itu proses isokorik
4. Perbandingan Berdampingan - Proses Isobarik vs Isokorik Dalam Bentuk Tabel
5. Ringkasan
Apa proses isobarik?
Proses isobarik adalah proses kimia yang terjadi dalam sistem termodinamika di bawah tekanan konstan. Oleh karena itu, perubahan tekanan atau ∆P adalah nol. Biasanya, sistem menjaga konstanta tekanan melalui memungkinkan volume sistem berubah; itu bisa berupa ekspansi atau kontraksi. Perubahan volume ini dapat menetralkan perubahan tekanan yang mungkin terjadi karena perpindahan panas antara sistem dan sekitarnya.

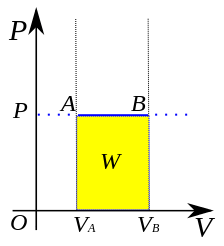
Gambar 01: Pekerjaan yang dilakukan dalam proses isobarik (area kuning)
Biasanya, dalam proses isobarik, perubahan energi internal (U). Oleh karena itu, pekerjaan (w) dilakukan oleh sistem selama perpindahan panas. Kita dapat menghitung pekerjaan dengan tekanan konstan menggunakan persamaan berikut.
W = p*∆V
Di sini, w adalah pekerjaan, p adalah tekanan dan ∆V adalah perubahan volume. Dengan demikian, jika perpindahan panas menyebabkan volume sistem mengembang, maka sistem melakukan pekerjaan positif sementara jika perpindahan panas menyebabkan volume sistem berkontraksi, maka sistem melakukan pekerjaan negatif pekerjaan negatif.
Apa itu proses isokorik?
Proses isokorik adalah proses kimia yang terjadi dalam sistem termodinamika di bawah volume konstan. Oleh karena itu, tidak ada perubahan volume; ∆V adalah nol. Karena volume tetap konstan, pekerjaan yang dilakukan oleh sistem adalah nol; Dengan demikian sistem tidak berfungsi. Sebagian besar waktu, ini adalah variabel termodinamika termudah untuk dikendalikan. Proses terjadi dalam wadah tertutup yang tidak mengembang atau kontrak.
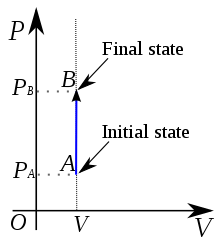
Gambar 02: Proses isokorik
Energi internal sistem termodinamika berubah sesuai dengan perpindahan panas. Namun, semua panas yang ditransfer baik meningkatkan atau mengurangi energi internal. Karena ∆V adalah nol, pekerjaan yang dilakukan oleh sistem (atau pekerjaan yang dilakukan pada sistem) juga nol. Jika U adalah energi internal dan Q adalah panas yang ditransfer;
∆U = q
Apa perbedaan antara proses isobarik dan isokoris?
Proses isobarik adalah proses kimia yang terjadi dalam sistem termodinamika di bawah tekanan konstan sementara proses isokorik adalah proses kimia yang terjadi dalam sistem termodinamika di bawah volume konstan. Ini adalah perbedaan utama antara proses isobarik dan isokoris. Ini berarti bahwa tekanan sistem termodinamika tetap tidak berubah selama proses isobarik sedangkan tekanan berubah sesuai dalam proses isokorik. Selain itu, volume perubahan sistem termodinamika selama proses isobarik sementara volume tetap konstan selama proses isokorik. Namun, dalam kedua proses, energi internal dari sistem berubah. Tetapi tidak seperti dalam proses isobarik, selama proses isokorik, semua panas yang ditransfer baik dikonversi menjadi energi internal atau berasal dari energi internal.
Infografis di bawah ini menyajikan lebih banyak detail tentang perbedaan antara proses isobarik dan isokorik dalam bentuk tabel.
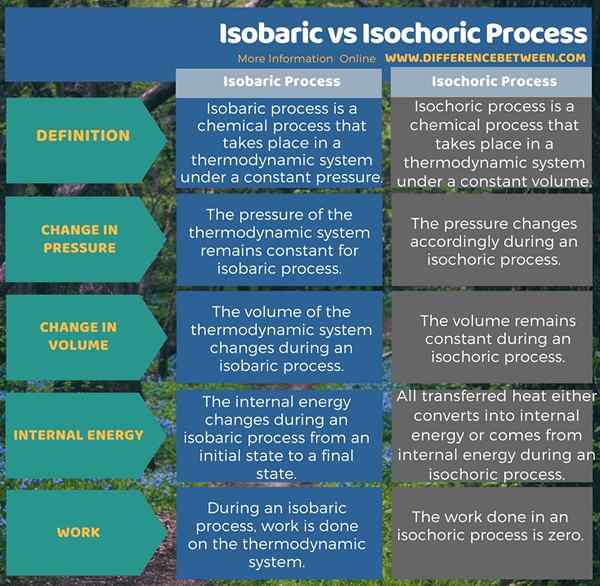
Ringkasan - Proses isobarik vs isokorik
Baik proses isobarik dan isokorik adalah proses termodinamika yang terjadi dalam sistem termodinamika sambil menjaga konstanta parameter. Oleh karena itu, perbedaan antara proses isobarik dan isokorik adalah bahwa proses isobarik terjadi pada tekanan konstan sedangkan proses isokorik terjadi pada volume konstan.
Referensi:
1. Jones, Andrew Zimmerman. “Proses isokorik."Thoughtco, Jun. 22, 2018. Tersedia disini
2. Jones, Andrew Zimmerman. “Di bawah Tekanan Konstan: Memahami Proses Isobarik."Thoughtco, Thoughtco. Tersedia disini
Gambar milik:
1."Proses isobarik Plain" oleh Ikamusumefan - karya sendiri, (CC BY -SA 3.0) Via Commons Wikimedia
2."Proses Isokorik SVG" oleh Ikamusumefan - karya sendiri, (CC BY -SA 3.0) Via Commons Wikimedia


