Perbedaan antara diagram latimer dan diagram frost
Itu perbedaan utama Antara diagram latimer dan diagram es Diagram Latimer merangkum potensi elektroda standar dari elemen kimia sedangkan diagram frost merangkum stabilitas relatif dari keadaan oksidasi yang berbeda dari suatu zat suatu zat.
Diagram Latimer dan Diagram Frost pada dasarnya penting dalam menunjukkan detail tentang reaksi redoks. Selain itu, diagram ini dinamai setelah para ilmuwan yang awalnya menciptakannya; Diagram Latimer mendapat namanya dari Wendell Mitchell Latimer sementara diagram Frost dinamai Arthur Atwater Frost.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu diagram latimer
3. Apa itu diagram es
4. Perbandingan Berdampingan - Diagram Latimer vs Diagram Frost Dalam Bentuk Tabel
5. Ringkasan
Apa itu diagram latimer?
Diagram Latimer adalah ringkasan potensi elektroda standar dari suatu elemen. Diagram ini dinamai ahli kimia Amerika Wendell Mitchell Latimer. Saat membangun diagram semacam ini, kita harus menulis bentuk unsur kimia yang sangat teroksidasi di sisi kiri. Kemudian kita dapat menulis keadaan oksidasi dalam urutan menurun ke kiri - sudut kiri akan memiliki keadaan oksidasi paling sedikit. Di antara keadaan oksidasi ini, kami menggunakan panah (panah ke kiri). Selain itu, di bagian atas panah, kita harus menulis potensi elektroda standar untuk reaksi konversi keadaan oksidasi di sisi kanan ke sisi kiri. Misalnya,
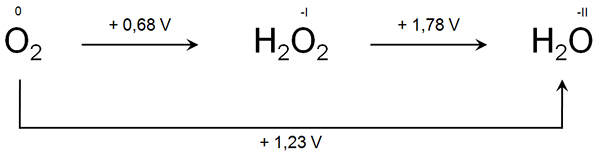
Gambar 01: Diagram Latimer yang menunjukkan keadaan oksidasi atom oksigen yang berbeda
Elemen kimia yang kami pertimbangkan dalam contoh di atas adalah oksigen. Ini memiliki spesies kimia berikut dengan keadaan oksidasi oksigen yang sesuai:
- HAI2 - keadaan oksidasi adalah nol
- H2HAI2 - Keadaan oksidasi oksigen adalah -1
- H2O - Keadaan oksidasi oksigen adalah -2
Diagram Latimer penting dalam membangun diagram beku karena kita dapat memperoleh potensi elektroda dari langkah-langkah reaksi yang tidak berdekatan yang diperlukan untuk pengembangan diagram es. Selain itu, penting dalam menunjukkan apakah spesies kimia tertentu mengalami deprotonasi di bawah kondisi di mana potensi elektroda diberikan.
Apa itu diagram es?
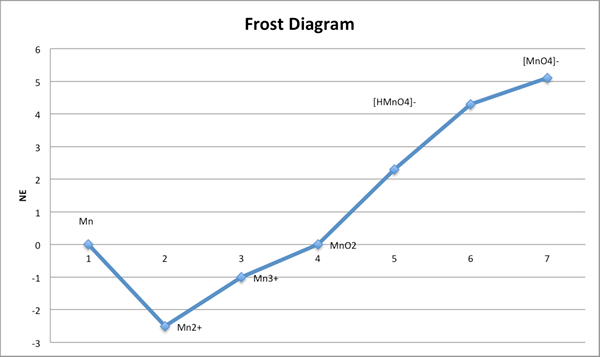
Diagram Frost adalah ilustrasi yang menunjukkan stabilitas relatif dari berbagai keadaan oksidasi suatu zat. Itu penting dalam kimia dan elektrokimia anorganik. Selain itu, ini adalah grafik, dan memiliki keadaan oksidasi pada sumbu x dan energi bebas pada sumbu y. Di sini, grafik tergantung pada pH. Oleh karena itu kita perlu memasukkan pH di mana kita melakukan pengukuran. Kita dapat menentukan energi bebas menggunakan pengurangan oksidasi setengah reaksi. Selain itu, kita dapat menentukan potensi reduksi dengan mudah menggunakan diagram ini daripada menggunakan diagram latimer.

Gambar 02: Diagram Frost
Saat membangun diagram, kita perlu menandai keadaan oksidasi pada sumbu x dan energi bebas pada sumbu y dengan nol di tengah. Karena, energi bebas memiliki nilai negatif dan positif. Selain itu, kemiringan grafik menunjukkan potensial elektroda standar antara kedua keadaan oksidasi.
Apa perbedaan antara diagram latimer dan diagram frost?
Diagram Latimer dan Diagram Frost penting dalam menentukan informasi tentang oksidasi dan pengurangan reaksi redoks. Namun, perbedaan utama antara diagram latimer dan diagram frost adalah bahwa diagram latimer merangkum potensi elektroda standar dari elemen kimia, tetapi diagram beku merangkum stabilitas relatif dari keadaan oksidasi yang berbeda dari suatu zat suatu zat suatu zat suatu zat.
Infografis di bawah ini merangkum perbedaan antara diagram latimer dan diagram frost dalam bentuk tabel.
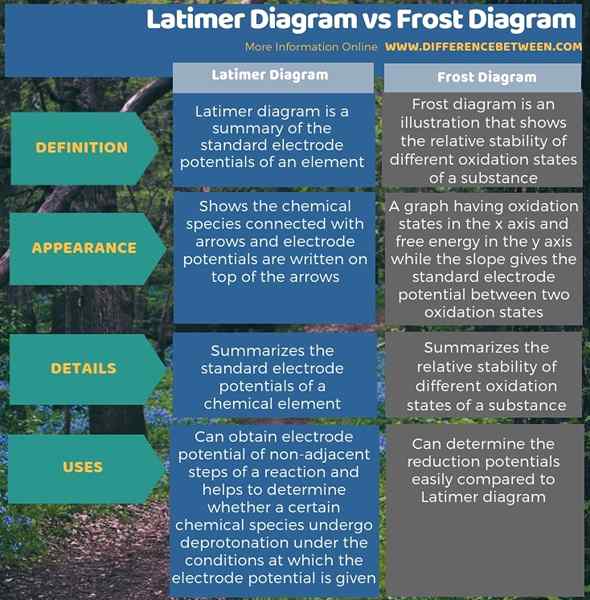
Ringkasan -Diagram Latimer vs Diagram Frost
Secara keseluruhan, Diagram Latimer dan Diagram Frost membantu kami menentukan informasi tentang oksidasi dan pengurangan reaksi redoks. Tapi, perbedaan utama antara diagram latimer dan diagram frost adalah bahwa diagram latimer merangkum potensi elektroda standar dari elemen kimia, sedangkan diagram frost merangkum stabilitas relatif dari keadaan oksidasi yang berbeda dari suatu zat suatu zat suatu zat suatu zat suatu zat yang berbeda.
Referensi:
1. “Diagram yang digunakan dalam kimia redoks. Universitas Oregon Barat, tersedia di sini.
2. “4.3: Diagram Latimer dan Frost.”Kimia Libretexts, Libretexts, 5 Juni 2019, tersedia di sini.
Gambar milik:
1. "Latimerdiagram Zuurstof" oleh Dr.T - Pekerjaan Sendiri (CC BY -SA 3.0) Via Commons Wikimedia
2. "Diagram Frost" oleh JLange1125 - Saya membuat diagram di Excel (CC BY -SA 3.0) Via Commons Wikimedia


