Perbedaan antara energi kisi dan energi hidrasi
Perbedaan utama - kisi Energi vs energi hidrasi
Energi kisi dan energi hidrasi adalah dua istilah terkait dalam termodinamika. Energi kisi adalah jumlah energi yang dilepaskan saat kisi terbentuk. Energi hidrasi adalah energi yang dilepaskan saat kisi larut dalam air. Baik pembentukan dan hidrasi energi pelepasan kisi karena kedua proses melibatkan ikatan kimia (atau interaksi kimia) pembentukan. Itu perbedaan utama Antara energi kisi dan energi hidrasi adalah itu Energi kisi adalah jumlah energi yang dilepaskan ketika mol kisi terbentuk dari ion yang terpisah tanpa batas sedangkan energi hidrasi adalah jumlah energi yang dilepaskan ketika kisi dipisahkan menjadi ion dengan solvasi dalam air.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu energi kisi
3. Apa itu energi hidrasi
4. Hubungan antara energi kisi dan energi hidrasi
5. Perbandingan Berdampingan - Energi Kisi vs Energi Hidrasi Dalam Bentuk Tabel
6. Ringkasan
Apa itu energi kisi?
Energi kisi adalah ukuran energi yang terkandung dalam kisi kristal senyawa, yang sama dengan energi yang akan dilepaskan jika ion komponen disatukan dari tak terbatas. Dengan kata lain, energi kisi adalah energi yang dibutuhkan dalam pembentukan kristal dari ion yang benar -benar terpisah. Sangat sulit untuk mengukur energi kisi secara eksperimental. Oleh karena itu, itu diturunkan secara teoritis.
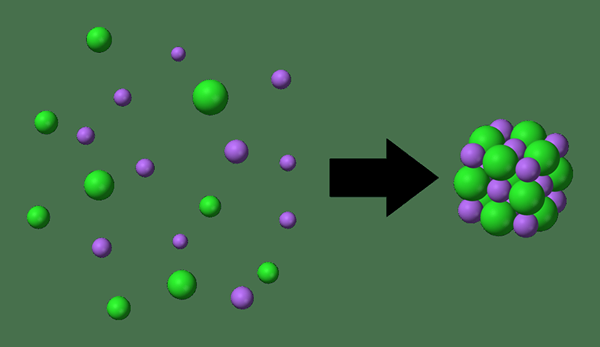
Gambar 01: Energi Kisi
Nilai energi kisi selalu merupakan nilai negatif. Itu karena pembentukan kisi melibatkan pembentukan ikatan kimia. Pembentukan ikatan kimia adalah reaksi kimia eksotermik, yang melepaskan energi. Nilai teoritis untuk energi kisi ditentukan sebagai berikut.
ΔGU = δGH- p.ΔVM
Di mana, ΔGU adalah energi kisi molar, ΔGEntalpi kisi molar dan ΔVM adalah perubahan volume per mol. P adalah tekanan eksternal. Oleh karena itu, energi kisi juga dapat didefinisikan sebagai pekerjaan yang harus dilakukan terhadap tekanan eksternal, p.
Apa itu energi hidrasi?
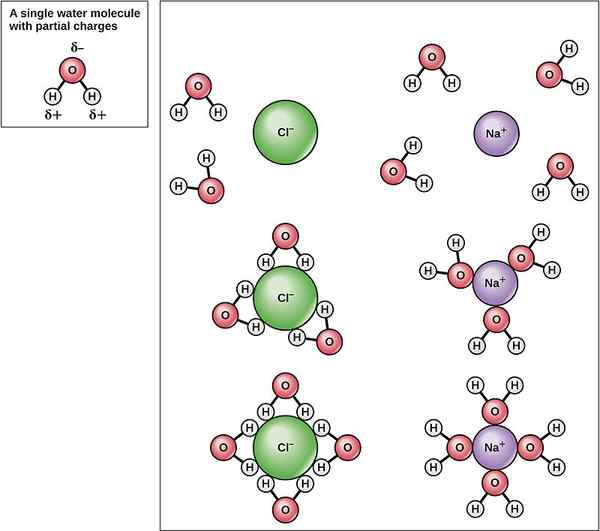
Energi hidrasi (atau entalpi hidrasi) adalah jumlah energi yang dilepaskan ketika satu mol ion mengalami hidrasi. Hidrasi adalah jenis khusus pembubaran ion dalam air. Ion dapat bermuatan positif atau spesies kimia bermuatan negatif. Ketika senyawa ionik padat dilarutkan dalam air, ion terluar dari padatan itu menjauh dari padatan dan dilarutkan dalam air. Di sana, ion yang dilepaskan ditutupi dengan molekul air tetangga.
Hidrasi senyawa ionik mencakup interaksi intramolekul. Ini adalah interaksi ion-dipole. Entalpi hidrasi atau energi hidrasi adalah energi yang dilepaskan saat ion dilarutkan dalam air. Hidrasi karenanya merupakan reaksi eksotermik. Itu karena pembubaran ion menciptakan interaksi antara ion dan molekul air. Pembentukan interaksi melepaskan energi karena hidrasi menstabilkan ion dalam larutan berair.

Gambar 02: Hidrasi Na+ dan Cl-ion
Energi hidrasi dilambangkan sebagai hHyd. Ketika energi hidrasi ion yang berbeda dipertimbangkan, nilai energi hidrasi berkurang dengan meningkatnya ukuran ionik. Itu karena, ketika ukuran ionik meningkat, kepadatan elektron ion berkurang. Maka interaksi antara ion dan molekul air juga menurun yang mengakibatkan penurunan energi hidrasi.
Apa hubungan antara energi kisi dan energi hidrasi?
- Energi pembubaran sama dengan jumlah energi kisi dan energi hidrasi. Itu karena, untuk melarutkan kisi dalam air, kisi harus menjalani disosiasi dan hidrasi. Kisi harus dilengkapi dengan jumlah energi yang dapat memisahkan kisi menjadi ion. Ini sama dengan energi kisi.
Apa perbedaan antara energi kisi dan energi hidrasi?
Energi kisi vs energi hidrasi | |
| Energi kisi adalah ukuran energi yang terkandung dalam kisi kristal senyawa, sama dengan energi yang akan dilepaskan jika ion komponen disatukan dari tak terbatas. | Hidrasi (atau entalpi hidrasi) adalah jumlah energi yang dilepaskan ketika satu mol ion mengalami hidrasi. |
| Energi | |
| Energi kisi adalah jumlah energi yang dilepaskan ketika mol kisi terbentuk dari ion yang terpisah tanpa batas. | Energi hidrasi adalah jumlah energi yang dilepaskan ketika kisi dipisahkan menjadi ion dengan solvasi dalam air. |
| Proses | |
| Energi kisi berkaitan dengan pembentukan kisi. | Energi hidrasi berkaitan dengan penghancuran kisi. |
Ringkasan - Kisi Energi vs energi hidrasi
Energi kisi berkaitan dengan pembentukan kisi sedangkan energi hidrasi berkaitan dengan penghancuran kisi. Perbedaan antara energi kisi dan energi hidrasi adalah bahwa energi kisi adalah jumlah energi yang dilepaskan ketika mol kisi terbentuk dari ion yang terpisah tanpa batas sedangkan energi hidrasi adalah jumlah energi yang dilepaskan ketika kisi dipisahkan menjadi ion dengan pelarut dalam air.
Referensi:
1.“Energi kisi.”Wikipedia, Wikimedia Foundation, 28 Feb. 2018. Tersedia disini
2.“Energi Kisi: Siklus Haber Terlahir.”Kimia Libretexts, Libretexts, 15 Feb. 2017. Tersedia disini
Gambar milik:
1.'Kisi-enthalpy-NaCl-3d-ionic'by benjah-bmm27-karya sendiri, (domain publik) via commons wikimedia
2.'Osc Microbio 00 AA Hydration'by CNX OpenStax (CC oleh 4.0) Via Commons Wikimedia


