Perbedaan antara molekul dan kisi

Itu perbedaan utama Antara molekul dan kisi adalah bahwa a Molekul mengandung atom yang terikat satu sama lain sedangkan kisi mengandung atom, molekul atau ion yang terikat satu sama lain.
Atom bergabung bersama untuk membentuk berbagai zat kimia. Menurut pengaturan mereka, sifat mereka berubah. Unit paling sederhana yang dapat terbentuk saat atom mengikat satu sama lain adalah molekul. Jika sejumlah besar atom, ion atau molekul bergabung satu sama lain, maka hasilnya adalah kisi. Kisi memiliki struktur yang sangat dipesan dan massa molar yang sangat tinggi.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu molekul
3. Apa itu kisi
4. Perbandingan berdampingan - molekul vs kisi dalam bentuk tabel
5. Ringkasan
Apa itu molekul?
Molekul terdiri dari dua atom yang terikat secara kimia atau lebih dari elemen yang sama (e.G., HAI2, N2) atau elemen yang berbeda (h2O, NH3). Molekul tidak memiliki muatan, dan atom mengikat satu sama lain melalui ikatan kovalen. Selain itu, mereka bisa sangat besar (hemoglobin) atau sangat kecil (h2), tergantung pada jumlah atom yang terhubung satu sama lain.

Gambar 01: Molekul air
Formula molekul molekul menunjukkan jenis dan jumlah atom dalam molekul. Formula empiris memberikan rasio integer paling sederhana dari atom yang ada dalam molekul. Misalnya, c6H12HAI6 adalah formula molekul glukosa, dan ch2O adalah formula empiris. Massa molekul adalah massa yang kami hitung mempertimbangkan jumlah total atom dalam formula molekul. Selain itu, setiap molekul memiliki geometri sendiri. Selain itu, atom dalam molekul mengatur dengan cara yang paling stabil dengan sudut ikatan spesifik dan panjang ikatan untuk meminimalkan tolakan dan gaya regangan.
Apa itu kisi?
Kisi adalah jaringan besar atom yang memiliki struktur yang dipesan. Dalam kimia, kita dapat melihat berbagai jenis kisi ionik dan kovalen. Kita dapat mendefinisikan kisi sebagai padatan yang memiliki pengaturan yang dipesan tiga dimensi dari unit dasar. Unit dasar dapat berupa atom, molekul atau ion. Dengan demikian, kisi adalah struktur kristal dengan unit dasar yang berulang ini.
Selanjutnya, jika jaringan ini berisi ion yang bergabung dengan ikatan ionik, kami menyebutnya sebagai kristal ionik. Misalnya, natrium klorida adalah kisi ionik. Sodium adalah logam grup 1, dengan demikian membentuk kation yang diisi +1 sebagai kationnya yang paling stabil. Klorin adalah non -logam dan memiliki kemampuan untuk membentuk anion yang diisi -1. Di kisi, enam ion klorida mengelilingi setiap ion natrium dan sebaliknya. Karena semua atraksi elektrostatik antara ion, struktur kisi sangat stabil. Jumlah ion yang ada dalam kisi bervariasi dengan ukurannya. Energi kisi atau entalpi kisi adalah ukuran kekuatan ikatan ionik di kisi. Entalpi kisi biasanya eksotermik.
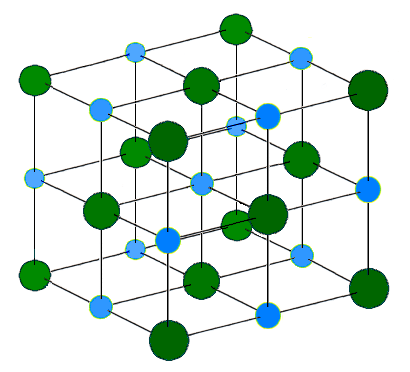
Gambar 02: Struktur kisi natrium klorida
Berlian dan Kuarsa adalah dua contoh kisi kovalen tiga dimensi. Berlian hanya terdiri dari atom karbon, dan masing -masing atom karbon secara kovalen berikatan dengan empat atom karbon lainnya untuk membentuk struktur kisi. Jadi setiap atom karbon memiliki pengaturan tetrahedral. Berlian memiliki stabilitas tinggi karena struktur ini. (Berlian adalah salah satu mineral terkuat di bumi.) Kuarsa atau silikon dioksida juga memiliki ikatan kovalen, tetapi ikatan ini ada antara atom silikon dan oksigen (kisi atom yang berbeda). Kedua kisi kovalen ini memiliki titik leleh yang sangat tinggi, dan mereka tidak dapat menghantarkan listrik.
Apa perbedaan antara molekul dan kisi?
Molekul terbentuk ketika dua atau lebih atom mengikat satu sama lain baik melalui ikatan kimia kovalen atau ikatan ionik. Di sisi lain, kisi terbentuk ketika sejumlah besar atom, molekul atau ikatan ion satu sama lain untuk membentuk struktur jaringan biasa. Oleh karena itu, perbedaan utama antara molekul dan kisi adalah bahwa molekul mengandung atom yang terikat satu sama lain sedangkan kisi -kisi mengandung atom, molekul atau ion yang terikat satu sama lain.
Sebagai perbedaan penting lainnya antara molekul dan kisi, kita dapat mengatakan bahwa molekul dapat terjadi sebagai padatan, cairan atau gas sedangkan kisi -kisi hanya terjadi sebagai zat padat. Selain itu, massa molekul sangat rendah dibandingkan dengan massa kisi karena jumlah atom dalam kisi relatif sangat tinggi.
Lebih banyak perbedaan ditunjukkan di bawah ini dalam infografis perbedaan antara molekul dan kisi.
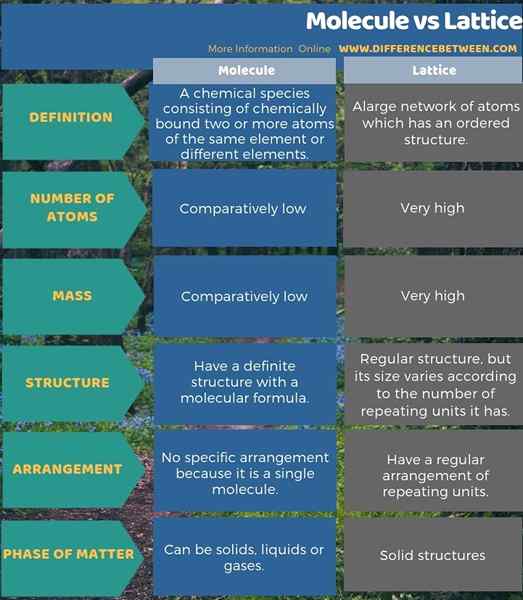
Ringkasan - molekul vs kisi
Molekul dan kisi adalah dua istilah kimia penting dalam kimia. Mereka berbeda satu sama lain; dengan demikian kita tidak dapat menggunakannya secara bergantian. Perbedaan utama antara molekul dan kisi adalah bahwa molekul mengandung atom yang terikat satu sama lain sedangkan kisi -kisi mengandung atom, molekul atau ion yang terikat satu sama lain.
Referensi:
1. Libretexts. “Struktur Ionik.”Kimia Libretexts, National Science Foundation, 19 Juni 2017. Tersedia disini
2. Helmenstine, Anne Marie, PH.D. “Apa itu molekul?"Thoughtco, Jun. 11, 2018. Tersedia disini
Gambar milik:
1."Water Molecule 3D" oleh DBC334 (versi pertama); Jynto (Versi Kedua)-Water-3D-VDW.PNG, (domain publik) via commons wikimedia
2.”Sodium Chloride Crystal” oleh H Padleckas (Domain Publik) via Commons Wikimedia


