Perbedaan antara oktet dan duplet
Perbedaan Kunci - Octet vs Duplet
Ada atom atau senyawa yang aktif secara kimia dan tidak aktif yang ada di alam. Karakteristik ini terutama tergantung pada jumlah elektron yang ada di cangkang terluar atom. Atom yang memiliki cangkang yang tidak lengkap dapat menjadi aktif untuk menyelesaikan konfigurasi elektron mereka menjadi stabil. Atom yang tidak aktif memiliki konfigurasi elektron lengkap; Dengan demikian, atom -atom ini tidak bereaksi dengan atom lainnya kecuali dalam kondisi khusus. Gas mulia selalu tidak aktif di alam. Oleh karena itu, mereka dikenal sebagai gas inert. Gas inert berada di kolom kedelapan di tabel periodik. Elemen lain pada periode yang sama (baris) cenderung mendapatkan konfigurasi elektron gas inert pada akhir periode itu, yang merupakan bentuk yang paling stabil di alam. Atom aktif cenderung melengkapi jumlah elektron menurut aturan oktet atau aturan duplet. Perbedaan utama antara oktet dan duplet adalah itu Octet adalah atom atau ion yang memiliki maksimal delapan elektron di cangkang terluar ketika Duplet adalah atom yang memiliki maksimum dua elektron di cangkang terluar.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu oktet
3. Apa itu duplet
4. Perbandingan berdampingan - octet vs duplet
5. Ringkasan
Apa itu oktet?
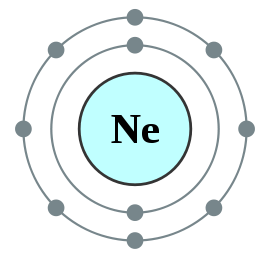
Oktet adalah atom atau ion yang memiliki delapan elektron di cangkang terluar dari atom itu. Semua gas mulia kecuali helium memiliki delapan elektron dan bersifat lembam. Konfigurasi elektron gas mulia akan selalu berakhir sebagai berikut.
ns2 np6
Misalnya, konfigurasi elektron neon adalah 1s22s22p6 . Neon adalah gas lembam.
Elemen lain yang memiliki tujuh, enam, dll. elektron di orbital terluar cenderung mematuhi aturan oktet dengan mendapatkan elektron dari luar; beberapa elemen lain yang memiliki satu, dua, dll. elektron cenderung kehilangan elektron dan mendapatkan konfigurasi elektron gas inert terdekat. Tetapi elemen lain di tengah tabel periodik akan membentuk ikatan baru dengan elemen yang memiliki kelebihan elektron untuk berbagi elektron dan menjadi oktet.
Gambar 01: Neon, sebuah oktet
Apa itu duplet?
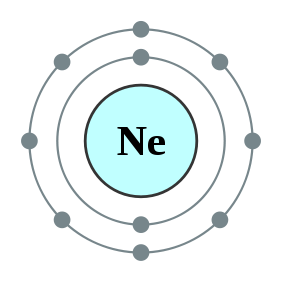
Atom hidrogen dan atom helium adalah elemen terkecil di alam dan hanya memiliki satu orbital di sekitar nukleus mereka. Orbital ini disebut orbital 1s. Orbital ini dapat mengandung maksimal dua elektron. Atom hidrogen memiliki satu elektron dan helium memiliki dua elektron. Karenanya, helium disebut duplet. Helium memiliki jumlah maksimum elektron yang dapat dimiliki; Dengan demikian itu adalah elemen yang stabil di alam. Oleh karena itu, helium juga merupakan gas lembam. Tetapi hidrogen hanya memiliki satu elektron dan satu -satunya orbital yang dimiliki tidak lengkap. Dengan demikian, atom hidrogen saja sangat reaktif dan cenderung membentuk ikatan kovalen dengan atom hidrogen lain dengan berbagi satu -satunya elektron yang mereka miliki. Kemudian atom hidrogen ini menjadi duplet karena mereka sekarang memiliki dua elektron di orbital terluarnya. Tapi lithium juga bisa berperilaku sebagai duplet dengan melepas elektron dari orbital terluarnya. Konfigurasi elektron lithium adalah 1s22s1. Dengan menghapus 2s1 elektron, itu bisa menjadi duplet. Dalam hal ini, dia, h- dan li+ adalah duplet yang bisa ada sebagai duplet yang stabil.
Semua duplet memiliki konfigurasi elektron yang berakhir sebagai berikut.
ns2

Gambar 02: helium, duplet
Apa perbedaan antara oktet dan duplet?
Octet vs Duplet | |
| Octet memiliki delapan elektron di cangkang terluar. | Duplet memiliki dua elektron di cangkang terluar. |
| Konfigurasi Elektron Umum | |
| Octet memiliki NS2 np6 Ketik konfigurasi elektron di akhir. | Duplet memiliki NS2 Ketik konfigurasi di akhir. |
| Jumlah orbital | |
| Octet mungkin memiliki minimal dua orbital. | Duplet hanya memiliki satu orbital. |
| Jenis orbital | |
| Octet dapat memiliki semua jenis orbital seperti S, P, D, F, dll. | Duplet hanya memiliki orbital. |
Ringkasan - Octet vs Duplet
Semua elemen cenderung menjadi stabil. Tetapi dengan konfigurasi elektron yang tidak lengkap, atom tidak dapat stabil; Dengan demikian, mereka menjadi sangat reaktif untuk mengisi cangkang dengan elektron dengan mendapatkan, kehilangan atau berbagi elektron. Atom atau molekul yang mematuhi aturan oktet atau duplet stabil. Perbedaan utama antara oktet dan duplet adalah bahwa oktet memiliki delapan elektron di orbital terluar sedangkan duplet memiliki dua elektron dalam orbitnya.
Referensi:
1. Nema, hlm., 2011. TopperLearning. [Online] Tersedia di: http: // www.TopperLearning.com/forum/home-work-help-19/what-is-octet-duplet-valensi-dan-ion-chemistry-struktur-of-atom-46317/balasan [Diakses 29 05 2017].
2.Chang, r., 2010. Kimia. Edisi ke -10. New York: McGraw-Hill.
3.Segera., 2015. Stacker kelas. [Online] Tersedia di: http: // gradestack.com/ntse-course-course/kimia-bonding/kimia-aktivitas-of-an/19176-3853-37737-study-wtw [Diakses 29 05 2017].
Gambar milik:
1. “Electron Shell 002 Helium - No Label” oleh Pumbaa (karya asli oleh Greg Robson) - Diagram Shell Elektron (Versi Berlabel yang sesuai) (CC BY -SA 2.0 uk) via commons wikimedia
2. “Electron Shell 010 Neon” oleh Pumbaa (karya asli oleh Greg Robson) (CC BY-SA 2.0 uk) via commons wikimedia


