Perbedaan antara molekul kutub dan dipolar
Itu perbedaan utama antara molekul kutub dan dipolar adalah itu Molekul polar memiliki dua ujung yang berlawanan dengan muatan listrik yang berlawanan, Sedangkan molekul dipolar memiliki dua kutub.
Secara umum, kita dapat menggunakan istilah polar dan dipolar secara bergantian karena kedua istilah ini menggambarkan molekul tunggal yang memiliki dua ujung yang berlawanan. Ujung yang berbeda ini muncul karena perbedaan dalam distribusi elektron di seluruh molekul.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu molekul kutub
3. Apa itu molekul dipolar
4. Perbandingan Berdampingan - Molekul Polar vs Dipolar Dalam Bentuk Tabel
5. Ringkasan
Apa itu molekul kutub?
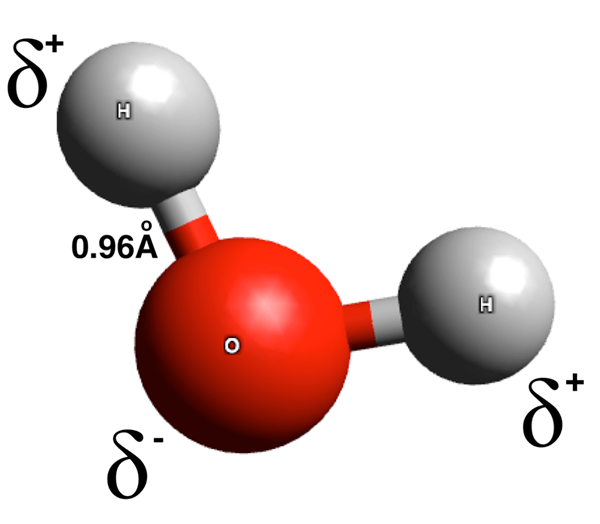
Molekul kutub adalah spesies kimia yang memiliki ikatan kutub. Jumlah momen dipol dari ikatan kutub ini tidak sama dengan nol. Obligasi kutub memiliki ujung yang dibebankan sebagian positif dan ujung yang dibebankan sebagian negatif. Biaya listrik ini muncul karena perbedaan dalam distribusi elektron di seluruh ikatan kimia. Perbedaan distribusi elektron adalah hasil dari perbedaan nilai elektronegativitas atom dalam ikatan kimia. Di sini, atom yang lebih elektronegatif menarik elektron pasangan elektron ikatan ke arah dirinya sendiri, yang memberi atom ini muatan negatif parsial. Akibatnya, atom lain dalam ikatan ini mendapat muatan positif parsial karena kurangnya kepadatan elektron di sekitarnya, yang mengungkapkan muatan positif proton dalam inti atom.

Gambar 01: Pemisahan muatan dalam molekul air
Selain itu, molekul kutub dapat terbentuk ketika susunan spasial molekul (geometri) membuat muatan positif berkumpul di satu sisi molekul dan muatan negatif di sisi yang berlawanan. Beberapa contoh umum molekul poplar termasuk air, amonia, etanol, sulfur dioksida, dan hidrogen sulfida.
Apa itu molekul dipolar?
Molekul dipolar adalah spesies kimia yang memiliki dua kutub dalam molekul yang sama. Momen dipol terjadi ketika ada pemisahan dalam muatan listrik karena distribusi elektron yang tidak merata di seluruh molekul. Momen dipol terjadi karena perbedaan nilai elektronegativitas atom dalam molekul. Tidak seperti senyawa kutub, molekul dipolar netral secara elektrik (muatan listrik keseluruhan molekul adalah nol). Ini karena pemisahan muatan molekul menunjukkan nilai muatan listrik yang persis sama dengan orientasi yang sebaliknya, yang saling membatalkan; Dengan demikian, tidak ada muatan bersih.
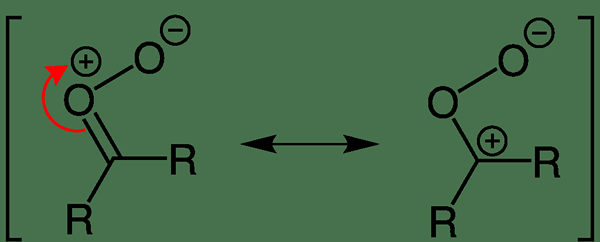
Gambar 02: Delokalisasi muatan listrik dalam karbonil oksida
Pada sebagian besar molekul dipolar, muatan didelokalisasi di seluruh molekul. Beberapa contoh termasuk karbonil oksida, diazometana, fosfonium ylide, dll.
Apa perbedaan antara molekul kutub dan dipolar?
Perbedaan utama antara molekul kutub dan dipolar adalah bahwa molekul polar memiliki dua ujung yang berlawanan dengan muatan listrik yang berlawanan, sedangkan molekul dipolar memiliki dua kutub. Namun, secara umum, kita dapat menggunakan istilah polar dan dipolar secara bergantian karena kedua istilah ini menggambarkan satu molekul tunggal yang memiliki dua ujung yang berlawanan.
Selain itu, perbedaan signifikan lainnya antara molekul polar dan dipolar adalah bahwa molekul polar terbentuk ketika ada pemisahan muatan sementara molekul dipolar terbentuk karena perbedaan nilai elektronegativitas atom.
Di bawah ini adalah ringkasan tabulasi perbedaan antara molekul kutub dan dipolar.

Ringkasan - Molekul Dipolar Polar vs
Singkatnya, kita dapat menggunakan istilah kutub dan kutub secara bergantian karena kedua istilah ini menggambarkan molekul tunggal yang memiliki dua ujung yang berlawanan. Perbedaan utama antara molekul kutub dan dipolar adalah bahwa molekul polar memiliki dua ujung yang berlawanan dengan muatan listrik yang berlawanan, sedangkan molekul dipolar memiliki dua kutub.
Referensi:
1. “13.3: Momen Polaritas dan Dipol Obligasi.”Kimia Libretexts, Libretexts, 3 Juni 2019, tersedia di sini.
2. “Senyawa dipolar.”Wikipedia, Wikimedia Foundation, 13 Juli 2018, tersedia di sini.
Gambar milik:
1. “Model Bola dan Stick Molekul Air” oleh Soonlorpai - Karya Sendiri (CC BY -SA 4.0) Via Commons Wikimedia
2. “Karbonil oksida (Criegee Zwitterion)” oleh Wickey -NL - Pekerjaan Sendiri (CC0) via Commons Wikimedia


