Perbedaan antara sel primer dan sekunder
Perbedaan utama - sel primer dan sekunder
Baterai digunakan saat penyimpanan tenaga listrik diperlukan. Mereka menumpuk dan memberikan muatan listrik sebagai arus listrik saat diperlukan. Baterai terdiri dari sel primer atau sekunder. Itu perbedaan utama Antara sel primer dan sekunder adalah reusability. Sel sekunder dapat digunakan kembali lagi dan lagi sementara sel primer hanya dapat digunakan sekali. Tujuan dan beban yang terhubung ke baterai tergantung pada jenis sel di dalamnya. Mungkin ada satu atau lebih sel dari satu jenis dalam baterai; Jadi itu menentukan tegangan, atau dengan kata lain, gaya elektromotif (EMF) dari baterai itu. Sel apa pun terdiri dari 3 bagian utama; yaitu, anoda, katoda, dan elektrolit.
Apa sel utama?
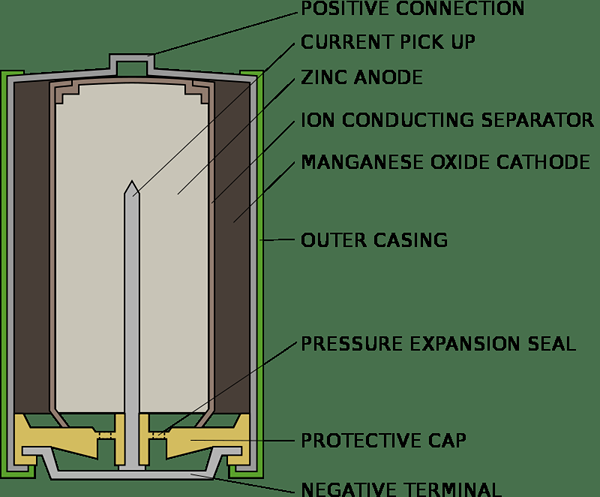
Sel primer dapat digunakan sekali dan dibuang. Mereka tidak dapat diisi ulang dan digunakan kembali. Label sel primer selalu menyatakan bahwa itu tidak boleh diisi ulang karena berbahaya untuk mencoba mengisi ulang dan dapat meledak, jika melakukannya. Sel kering dan sel merkuri adalah contoh untuk sel primer. Sel primer pada dasarnya adalah sel kimia dan menghasilkan arus listrik dengan reaksi kimia ireversibel. Setelah reaksi selesai, tidak dapat dibangun kembali. Untuk sesaat, sel kering terdiri dari katoda karbon yang dikelilingi oleh NH4Cl dalam wadah Zink. Pasta NH4CL dan ZNCL2 berfungsi sebagai elektrolit sementara wadah seng bertindak sebagai anoda. Sejumlah kecil mno2 juga dicampur dengan elektrolit. Proses kimia sel kering dapat dirangkum sebagai berikut;
Zn-> Zn2++2 elektron (reaksi anoda)
NH4+ + Mno2 + Elektron -> Mno (OH) + NH3 (Reaksi katoda)
Sel primer umumnya ditemukan dan digunakan di sebagian besar mainan listrik, jam, jam tangan dan pengontrol jarak jauh domestik.

Apa sel sekunder?
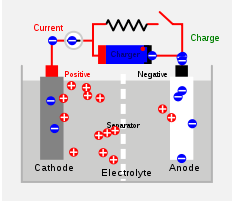
Sel sekunder juga merupakan sel kimia tetapi, dapat diisi ulang untuk digunakan lagi. Reaksi kimia yang menghasilkan listrik adalah reversibel, dan sel dapat digunakan sebagai yang baru setelah proses pengisian ulang. Sel dapat digunakan kembali tetapi masa hidup dipersingkat. Asam timbal dan sel kehidupan adalah beberapa contoh sel sekunder. Di sebuah Sel asam timbal, Timbal bertindak sebagai anoda dan kisi -kisi timbal yang dikemas dengan timbal dioksida bertindak sebagai katoda. Asam sulfat diisi untuk berfungsi sebagai elektrolit. Reaksi kimia di dalam sel timbal-asam diberikan di bawah ini. Mereka adalah proses reversibel.
Pb+jadi42- --> PBSO4 + 2 elektron (reaksi anoda)
Pbo2 + 4H+ + JADI42- + 2 Elektron -> PBSO4 + 2h2O (reaksi katoda)
Kendaraan hibrida modern ditenagai oleh minyak bumi dan tenaga listrik. Baterai mengisi saat mobil bergerak, dan kemudian daya listrik yang disimpan dapat digunakan untuk berjalan. Semua paket baterai di dalam mobil tersebut terbuat dari sel sekunder. Penggunaan umum lainnya untuk baterai sekunder adalah untuk memulai, pencahayaan, dan pengapian dalam kendaraan. Juga, mereka digunakan dalam catu daya tidak terputus (UPS), telekomunikasi, dan alat portabel.
Apa perbedaan antara sel primer dan sekunder?
Efektivitas biaya:
Menggunakan sel primer Biaya hemat dibandingkan dengan sel sekunder, pada awalnya.
Tetapi menggunakan sel sekunder akan menjadi investasi jangka panjang karena sel -sel primer harus digantikan oleh set lain setelah beberapa waktu.
Tingkat pelepasan diri:
Sel primer memiliki tingkat self-discharge yang lebih rendah sehingga mereka cocok untuk perangkat fungsi siaga yang membutuhkan arus kecil terus menerus untuk waktu yang lama. Ini adalah fakta penting atas nama peralatan keselamatan seperti detektor asap/ kebakaran, alarm pencuri dan jam.
Sel sekunder memiliki self-discharge yang lebih tinggi.
Biaya dan Penggunaan:
Sel primer murah dan mudah digunakan.
Sel sekunder mahal dan lebih kompleks dalam penggunaan.
Gambar milik:
1. “Alkaline-Battery-English” oleh Tympanus [domain publik] via commons
2. Diagram Sel Sekunder oleh Penulis Asli: Barrie Lawson. [CC BY-SA 3.0], via Wikimedia Commons


