Perbedaan antara efek isotop kinetik primer dan sekunder
Itu perbedaan utama Antara efek isotop kinetik primer dan sekunder adalah bahwa Efek isotop primer menggambarkan substitusi isotop pada ikatan yang rusak sedangkan efek isotop sekunder menggambarkan substitusi isotop pada ikatan yang berdekatan dengan ikatan yang rusak.
Efek isotop kinetik atau KIE mengacu pada perubahan laju reaksi reaksi kimia setelah substitusi isotop. Di sini, atom dalam reaktan digantikan oleh isotopnya sehingga laju reaksi akan berbeda dari laju awal. Maka kita dapat menentukan nilai KIE dengan membagi konstanta laju untuk reaksi yang melibatkan reaktan tersubstitusi isotopik dari konstanta laju untuk reaksi yang melibatkan reaktan tersubstitusi isotopik yang berat. Oleh karena itu, kie lebih besar dari 1 dianggap sebagai efek isotop kinetik normal sementara kie kurang dari 1 dianggap sebagai efek isotop kinetik terbalik.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa efek isotop kinetik primer
3. Apa efek isotop kinetik sekunder
4. Perbandingan berdampingan - Efek isotop kinetik primer vs sekunder dalam bentuk tabel
5. Ringkasan
Apa efek isotop kinetik primer?
Efek isotop kinetik primer adalah perubahan laju reaksi karena substitusi isotop di lokasi pemecahan ikatan. Di sini, substitusi ini berada dalam tahap pemecahan ikatan pada langkah penentu laju reaksi. Oleh karena itu, jenis efek isotopik ini merupakan indikasi pemecahan ikatan atau pembentukan ikatan ke isotop pada langkah pembatas laju.
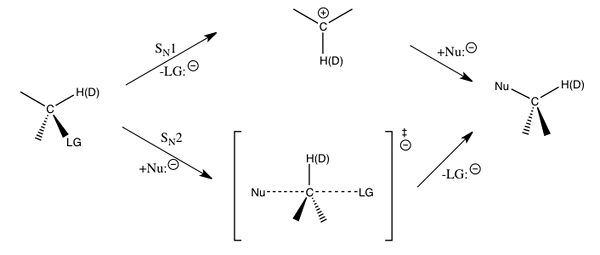
Untuk reaksi substitusi nukleofilik, efek isotop kinetik primer diterapkan untuk kelompok meninggalkan, nukleofil dan alfa-karbon di mana substitusi terjadi. Jenis efek kinetik ini kurang sensitif daripada kie yang ideal. Ini karena kontribusi faktor non-vibrasional.
Apa efek isotop kinetik sekunder?
Efek isotop kinetik sekunder adalah perubahan laju reaksi karena substitusi isotop di lokasi selain dari lokasi pemecahan ikatan. Dengan kata lain, ini menunjukkan bahwa tidak ada ikatan dengan atom berlabel isotopik yang rusak atau terbentuk. Seperti efek kinetik primer, ini juga terjadi pada langkah penentu tingkat. Ada tiga jenis efek kinetik sekunder yang disebut sebagai efek alfa, beta dan gamma.

Gambar 01: Substitusi nukleofilik dengan molekul yang mengalami hidrogen digantikan oleh deuterium
Tidak seperti Kie Primer, Kie sekunder cenderung jauh lebih kecil. Namun, kie jenis ini masih sangat berguna dalam menjelaskan mekanisme reaksi karena per atom deuterium, kie sekunder sangat besar. Selain itu, besarnya efek isotopik kinetik sekunder ditentukan oleh faktor getaran.
Apa perbedaan antara efek isotop kinetik primer dan sekunder?
Efek isotop kinetik atau KIE mengacu pada perubahan laju reaksi reaksi kimia setelah substitusi isotop. Perbedaan utama antara efek isotop kinetik primer dan sekunder adalah bahwa efek isotop primer menggambarkan substitusi isotop pada ikatan yang rusak, sedangkan efek isotop sekunder menggambarkan substitusi isotop pada ikatan yang berdekatan dengan ikatan yang rusak. Lebih jauh, tidak seperti Kie utama, Kie sekunder cenderung jauh lebih kecil.
Selain itu, besarnya efek isotop kinetik sekunder ditentukan oleh faktor getaran sementara efek isotop kinetik primer kurang sensitif karena faktor non-vibrasional.
Di bawah infografis merangkum perbedaan antara efek isotop kinetik primer dan sekunder.
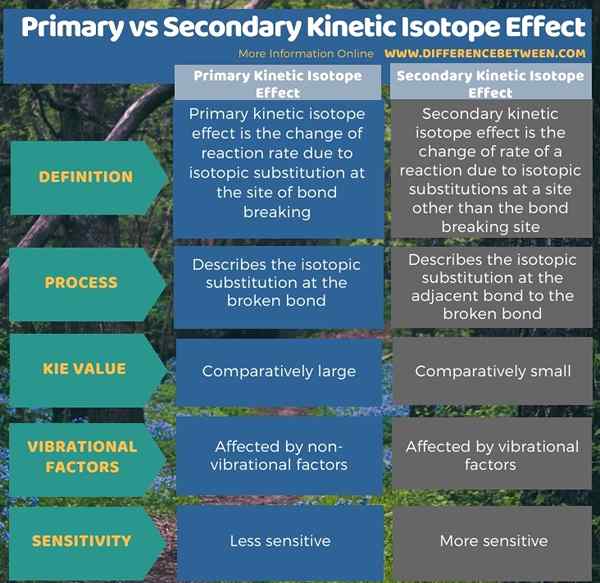
Ringkasan -Efek isotop kinetik primer vs sekunder
Efek isotop kinetik atau KIE mengacu pada perubahan laju reaksi reaksi kimia setelah substitusi isotop. Perbedaan utama antara efek isotop kinetik primer dan sekunder adalah bahwa efek isotop primer menggambarkan substitusi isotop pada ikatan yang rusak, sedangkan efek isotop sekunder menggambarkan substitusi isotop pada ikatan yang berdekatan dengan ikatan yang rusak.
Referensi:
1. “Efek isotop kinetik.”Wikipedia, Wikimedia Foundation, 8 Nov. 2019, tersedia di sini.
2. “Efek isotop kinetik.”Kimia Libretexts, Libretexts, 5 Juni 2019, tersedia di sini.
Gambar milik:
1. "Sn1 vs SN2" oleh Aykutaydin - karya sendiri (CC BY -SA 3.0) Via Commons Wikimedia


