Perbedaan antara orbital PX PY dan PZ
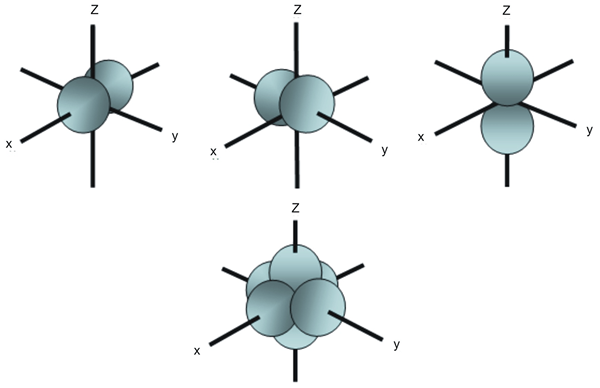
Perbedaan utama antara orbital PX PY dan PZ adalah bahwa PX Orbital memiliki dua lobus yang berorientasi di sepanjang sumbu x dan orbital Py memiliki dua lobus yang berorientasi di sepanjang sumbu y sedangkan, orbital PZ memiliki dua lobus yang berorientasi di sepanjang sumbu-z. Oleh karena itu, perbedaan antara orbital PX PY dan PZ muncul dari orientasi mereka di luar angkasa.
Orbital atom adalah daerah di sekitar inti atom, yang memiliki probabilitas tertinggi untuk menemukan elektron. Orbital atom dapat berupa orbital, orbital p, orbital, atau orbital f. Selain itu, ada tiga orbital P; Mereka adalah orbital PX, PY dan PZ.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu orbital px
3. Apa itu orbital py
4. Apa itu orbital PZ
5. Kesamaan antara orbital PX PY dan PZ
6. Perbandingan berdampingan - PX vs Py vs Pz Orbital dalam bentuk tabel
7. Ringkasan
Apa itu orbital px?
Orbital px adalah salah satu dari tiga orbital dan orients di sepanjang sumbu x. Selain itu, orbital ini memiliki dua lobus dan memiliki bentuk dumbbell. Angka kuantum adalah satu set angka yang membantu menamai orbital atom. Sistem ini memberikan orbital atom tertentu nama yang unik.

Gambar 1: orbital P yang berbeda dan orientasinya
Angka kuantum:
- Nomor kuantum prinsip (n) menjelaskan cangkang elektron. Contoh: n = 1, 2, 3…
- Nomor kuantum azimut atau angka kuantum momentum sudut (L) menjelaskan subsklells. Mis: L = 0, 1, 2…
- Nomor kuantum magnetik (m) menunjukkan keadaan kuantum unik dari suatu elektron. Mis: m =… -2, -1, 0, +1, +2…
- Putaran nomor kuantum menggambarkan putaran elektron. Mis: S = ±
Saat mempertimbangkan orbital PX, notasi kuantum adalah sebagai berikut.
- Saat n = 1, tidak ada orbital P.
- Saat n> 2, dan l = 1, ada orbital p. Kemudian, px adalah m = +1 atau m = -1.
- Dengan meningkatnya nilai N, ukuran lobus luar orbital PX meningkat secara bertahap sementara ukuran lobus bagian dalam berkurang.
Apa itu orbital py?
Py Orbital adalah salah satu dari tiga orbital P yang berorientasi pada sumbu y. Orbital ini memiliki dua lobus. Notasi kuantum orbital Py adalah sebagai berikut.
- Saat n = 1, tidak ada orbital P.
- Saat n> 2, dan l = 1, ada orbital p. Kemudian, py adalah m = +1 atau m = -1.
- Dengan meningkatnya nilai N, ukuran lobus luar orbital Py meningkat secara bertahap sementara ukuran lobus bagian dalam berkurang.
Apa itu orbital PZ?
Orbital PZ adalah salah satu dari tiga orbital P yang berorientasi pada sumbu z. Orbital ini memiliki dua lobus dan memiliki bentuk dumbbell. Notasi kuantum orbital Py adalah sebagai berikut:
- Saat n = 1, tidak ada orbital P.
- Saat n> 2, dan l = 1, ada orbital p. Kemudian, PZ adalah M = 0.
- Dengan meningkatnya nilai N, ukuran lobus luar orbital PZ meningkat secara bertahap sementara ukuran lobus bagian dalam berkurang.
Apa kesamaan antara orbital px py dan pz?
- PX PY dan PZ Orbital memiliki bentuk yang sama (bentuk dumbbell).
- Ketiga orbital P memiliki ukuran yang sama.
- Ukuran orbital ini berubah dengan meningkatnya nilai n.
- Ketiga orbital berisi dua lobus sepanjang orientasi sumbu yang sama.
Apa perbedaan antara orbital PX PY dan PZ?
PX PY vs PZ Orbital | ||
| PX Orbital adalah orbital yang berorientasi pada sumbu x. | Orbital py adalah orbital yang berorientasi pada sumbu y. | Pz Orbital adalah orbital yang berorientasi pada sumbu z. |
| Orientasi | ||
| Sepanjang sumbu x | Sepanjang sumbu y | Sepanjang sumbu z |
| Nilai angka kuantum magnetik (m) | ||
| Nilai untuk angka kuantum magnetik (m) adalah +1 atau -1. | Nilai untuk angka kuantum magnetik (m) adalah +1 atau -1 | Nilai untuk angka kuantum magnetik (m) adalah 0 (nol) |
Ringkasan -PX Py vs PZ Orbital
Ada tiga orbital atom P dalam atom. Nama PX, PY dan PZ, menunjukkan orientasi orbital di luar angkasa. Perbedaan utama antara orbital PX PY dan PZ adalah bahwa orbital PX memiliki dua lobus yang berorientasi di sepanjang sumbu x dan orbital Py memiliki dua lobus yang berorientasi di sepanjang sumbu y sedangkan orbital PZ memiliki dua lobus yang berorientasi di sepanjang sumbu-z.
Referensi:
1. “Orbital Atom.”Wikipedia, Wikimedia Foundation, 24 Apr. 2018, tersedia di sini.
2. Libretexts. “Orbital Atom.”Kimia Libretexts, Libretexts, 7 Feb. 2018, tersedia di sini.
3. Agray, Santosh. “Bentuk orbital."Meja Kimia, Tersedia Di Sini.
Gambar milik:
1."PX PY PZ Orbitals" oleh CK -12 Foundation - File: High School Chemistry.PDF, halaman 268 (CC BY-SA 3.0) Via Commons Wikimedia


