Perbedaan antara radikal dan valensi
Itu perbedaan utama antara radikal dan valensi adalah itu Radikal adalah spesies kimia yang memiliki elektron yang tidak berpasangan, sedangkan valensi adalah konsep kimia yang menggambarkan kemampuan elemen kimia untuk digabungkan dengan elemen kimia lain.
Radikal adalah spesies kimia yang sangat reaktif karena memiliki elektron yang tidak berpasangan. Valensi adalah kekuatan kombinasi suatu unsur, terutama yang diukur dengan jumlah atom hidrogen yang dapat digantikan atau digabungkan.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu radikal
3. Apa itu valensi
4. Perbandingan berdampingan - valensi radikal vs dalam bentuk tabel
5. Ringkasan
Apa itu radikal?
Radikal adalah spesies kimia yang memiliki elektron yang tidak berpasangan. Elektron yang tidak berpasangan adalah elektron valensi. Itu berarti; itu berada di kulit terluar atom. Radikal bisa berupa atom, molekul atau ion. Karena keberadaan elektron yang tidak berpasangan tidak stabil, radikal adalah spesies kimia yang sangat reaktif. Oleh karena itu, spesies kimia ini memiliki masa hidup yang sangat singkat.
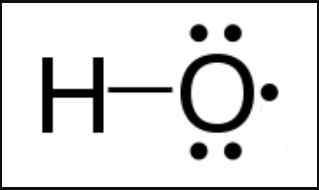
Gambar 01: Radikal Hidroksil
Selanjutnya, radikal dapat menghasilkan dengan cara yang berbeda. Metode khasnya adalah reaksi redoks. Metode penting lainnya termasuk radiasi pengion, panas, pelepasan listrik, elektrolisis, dll. Radikal ini adalah perantara dari banyak reaksi kimia.
Apa itu valensi?
Valensi adalah kekuatan kombinasi suatu unsur, terutama yang diukur dengan jumlah atom hidrogen yang dapat digantikan atau digabungkan. Ini adalah konsep kimia yang mengukur reaktivitas elemen kimia. Namun, itu hanya dapat menggambarkan konektivitas atom, tetapi tidak menggambarkan geometri suatu senyawa.
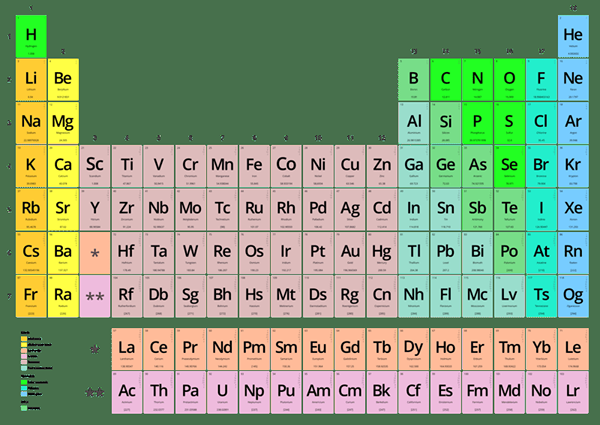
Kita dapat menentukan valensi elemen kimia dengan mengamati posisi elemen itu dalam tabel periodik. Tabel periodik memiliki semua elemen kimia sesuai dengan jumlah elektron dalam cangkang terluar atom. Jumlah elektron dalam cangkang terluar menentukan valensi atom juga. Misalnya, elemen grup 1 dalam tabel periodik memiliki satu elektron terluar. Oleh karena itu, mereka memiliki satu elektron untuk perpindahan atau kombinasi dengan atom hidrogen; Dengan demikian, valensi adalah 1.

Gambar 02: Tabel Periodik
Selain itu, kita dapat menentukan valensi menggunakan rumus kimia suatu senyawa. Di sini, dasar dari metode ini adalah aturan oktet. Menurut aturan oktet, atom cenderung melengkapi cangkang terluar dengan mengisi cangkang dengan elektron atau dengan melepas elektron tambahan. Misalnya, jika kita mempertimbangkan senyawa NaCl, valensi Na adalah 1 karena dapat menghilangkan satu elektron yang dimilikinya di cangkang terluar. Demikian pula, valensi CL juga 1 karena cenderung mendapatkan satu elektron untuk menyelesaikan oktetnya.
Namun, kita tidak boleh bingung dengan istilah nomor oksidasi dan valensi karena nomor oksidasi menggambarkan muatan yang dapat dibawa oleh atom. Misalnya, valensi nitrogen adalah 3, tetapi jumlah oksidasi dapat bervariasi dari -3 hingga +5.
Apa perbedaan antara radikal dan valensi?
Perbedaan utama antara radikal dan valensi adalah bahwa radikal adalah spesies kimia yang memiliki elektron yang tidak berpasangan, sedangkan valensi adalah konsep kimia yang menggambarkan kemampuan elemen kimia untuk digabungkan dengan elemen kimia lain. Dalam hal elektron, perbedaan antara radikal dan valensi adalah bahwa radikal memiliki satu elektron yang tidak berpasangan, sedangkan valensi elemen kimia menggambarkan elektron dalam cangkang terluar paling.
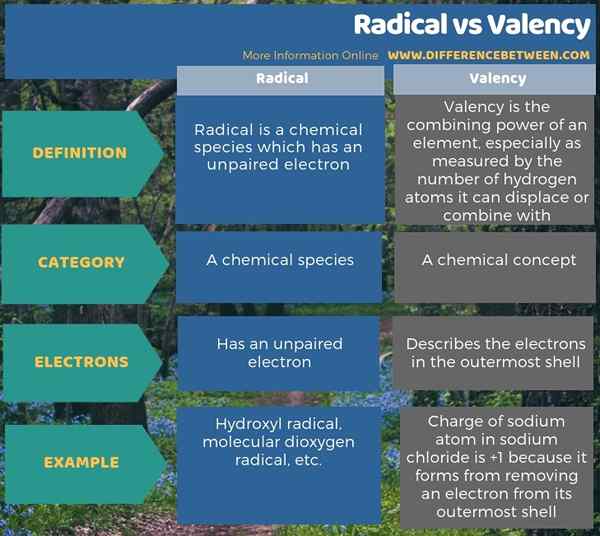
Ringkasan - Radikal vs Valensi
Perbedaan utama antara radikal dan valensi adalah bahwa radikal adalah spesies kimia yang memiliki elektron yang tidak berpasangan, sedangkan valensi adalah konsep kimia yang menggambarkan kemampuan elemen kimia untuk digabungkan dengan elemen kimia lain.
Referensi:
1. “Radikal (Kimia)." Wikipedia, Wikimedia Foundation, 25 Juni 2019, tersedia di sini.
Gambar milik:
1. "Hydroxyl Radical" oleh Smokeyjoe - karya sendiri (CC BY -SA 4.0) Via Commons Wikimedia
2. "Vektoral tabel periodik" oleh Rubén Vera Koster - karya sendiri (CC BY -SA 4.0) Via Commons Wikimedia


