Perbedaan antara Hukum Raoult dan Hukum Dalton
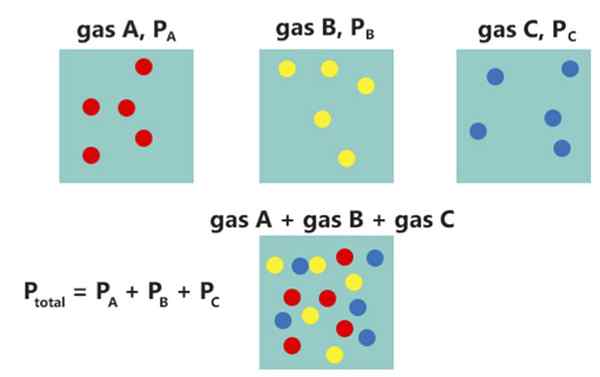
Itu perbedaan utama Antara Hukum Raoult dan Hukum Dalton adalah itu Hukum Raoult berkaitan dengan tekanan uap padatan atau cairan, sedangkan hukum Dalton berkaitan dengan tekanan parsial gas yang tidak bereaksi.
Hukum Raoult dan Hukum Dalton adalah hukum yang sangat penting dalam kimia yang menjelaskan tekanan parsial dari negara -negara gas. Hukum Raoult menggambarkan perilaku tekanan parsial uap suatu larutan saat mengubah konsentrasi zat terlarut. Sebaliknya, hukum Dalton menggambarkan perilaku gas yang tidak bereaksi di kapal yang sama.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu Raoult Law
3. Apa itu Dalton Law
4. Perbandingan berdampingan - Hukum Raoult vs Dalton Hukum dalam bentuk tabel
6. Ringkasan
Apa itu Raoult Law?
Hukum Raoult menyatakan bahwa tekanan uap pelarut di atas larutan sama dengan tekanan uap pelarut murni pada suhu yang sama yang diskalakan oleh fraksi mol dari pelarut yang ada dalam larutan. Kita dapat memberikan hubungan ini secara matematis sebagai berikut:
Plarutan= Xpelarut.PHaipelarut
Dimana halsoltuion adalah tekanan uap dari larutan, xpelarut adalah fraksi mol dari pelarut dan pHaipelarut adalah tekanan uap dari pelarut murni. Undang-undang ini dikembangkan oleh ahli kimia Prancis, François-Marie Raoult pada tahun 1880. Dia menemukan bahwa ketika menambahkan zat terlarut ke solusi, tekanan uap dari larutan secara bertahap berkurang. Namun, pengamatan ini tergantung pada dua variabel: fraksi mol dari tekanan terlarut dan tekanan uap dari pelarut murni.
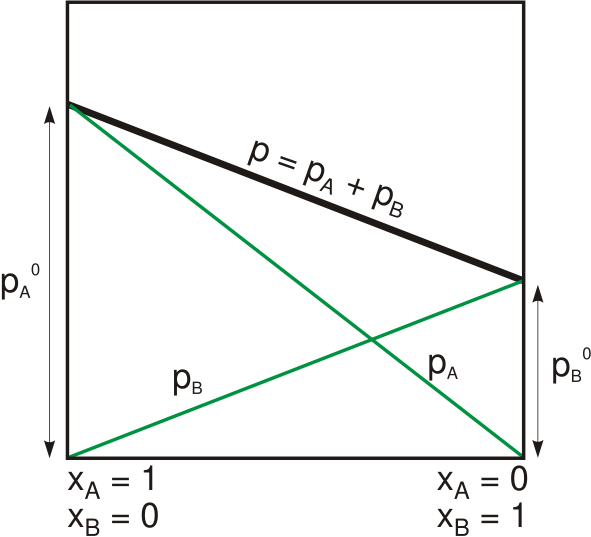
Gambar 01: Tekanan uap dari solusi biner yang mengikuti hukum Raoult
Pada tekanan tertentu untuk padatan atau cairan tertentu, ada tekanan di mana uap zat berada dalam kesetimbangan dengan zat dalam bentuk padat atau cair. Pada suhu itu, kami menyebutkan tekanan di atas zat sebagai tekanan uap. Selanjutnya, pada keseimbangan ini, laju penguapan zat padat atau cair sama dengan uap yang mengembun kembali ke bentuk padat atau cair. Jadi, ini adalah teori dasar di balik hukum Raoult. Namun, hukum Raoult bekerja untuk solusi ideal. Tetapi juga bekerja dengan baik dengan pelarut dalam keadaan yang sangat encer. Untuk zat nyata (bukan zat yang ideal), penurunan tekanan uap praktis lebih besar dari nilai yang kami hitung dari hukum raoult.
Apa itu Dalton Law?
Hukum Dalton menyatakan bahwa tekanan total campuran gas yang tidak bereaksi sama dengan jumlah tekanan parsial dari masing-masing gas. Undang -undang ini dikembangkan oleh John Dalton pada tahun 1802. Kita dapat memberikan hukum ini secara matematis sebagai berikut:
Ptotal= PSaya
Dimana haltotal adalah tekanan total campuran gas saat pSaya adalah tekanan parsial dari masing -masing gas individu.

Gambar 02: Hukum Dalton
Misalnya, jika kita memiliki campuran gas yang tidak bereaksi dengan tiga komponen di dalamnya, kita dapat menulis hubungan sebagai berikut:
Ptotal = P1+P2+P3
Apa perbedaan antara hukum raoult dan hukum dalton?
Hukum Raoult dan Hukum Dalton adalah hukum yang sangat penting dalam kimia yang menjelaskan tekanan parsial dari negara -negara gas. Perbedaan utama antara hukum Raoult dan hukum Dalton adalah bahwa hukum Raoult berkaitan dengan tekanan uap padatan atau cairan, sedangkan hukum Dalton membahas tekanan parsial gas yang tidak bereaksi. Itu adalah; Undang -undang Raoult menyatakan bahwa tekanan uap pelarut di atas larutan sama dengan tekanan uap pelarut murni pada suhu yang sama yang diskalakan oleh fraksi mol dari pelarut yang ada dalam larutan. Sementara itu, hukum Dalton menyatakan bahwa tekanan total campuran gas yang tidak bereaksi sama dengan jumlah tekanan parsial masing-masing gas. Ekspresi matematika untuk hukum raoult adalah plarutan= Xpelarut.PHaipelarut sedangkan ekspresi matematika untuk hukum Dalton adalah ptotal= PSaya.

Ringkasan -Hukum Raoult vs Hukum Dalton
Hukum Raoult dan Hukum Dalton adalah hukum yang sangat penting dalam kimia yang menjelaskan tekanan parsial dari negara -negara gas. Namun, perbedaan utama antara hukum Raoult dan hukum Dalton adalah bahwa hukum Raoult berkaitan dengan tekanan uap padatan atau cairan, sedangkan hukum Dalton membahas tekanan parsial gas yang tidak bereaksi.
Referensi:
1. Helmenstine, Anne Marie. “Definisi Hukum Raoult dalam Kimia."Thoughtco, Jan. 9, 2019, tersedia di sini.
Gambar milik:
1. "Raoultov Zakon" (domain publik) melalui Commons Wikimedia
2. “Skema yang menggambarkan hukum Dalton” oleh Blyumj - karya sendiri (CC BY -SA 4.0) Via Commons Wikimedia


