Perbedaan antara ekspresi tingkat dan hukum tingkat

Itu perbedaan utama antara ekspresi tingkat dan hukum tingkat itu Ekspresi laju memberikan laju penampilan atau hilangnya produk atau reaktan, sedangkan hukum tingkat memberikan hubungan antara laju dan konsentrasi atau tekanan reaktan.
Ketika satu atau lebih reaktan dikonversi menjadi produk, mereka dapat melalui berbagai modifikasi dan perubahan energi. Ikatan kimia dalam reaktan rusak, dan ikatan baru dibentuk untuk menghasilkan produk yang sama sekali berbeda dari reaktan. Modifikasi kimia ini dikenal sebagai reaksi kimia. Ekspresi laju dan hukum tingkat adalah konsep kimia penting yang dapat kita jelaskan dalam reaksi kimia.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu Ekspresi Laju
3. Apa itu Tingkat Hukum
4. Perbandingan Berdampingan - Laju Ekspresi Vs Laju Hukum Tabel Dalam Bentuk Tabel
5. Ringkasan
Apa itu Ekspresi Laju?
Ekspresi laju adalah cara mewakili perubahan konsentrasi reaktan selama waktu reaksi. Kita dapat memberikan ekspresi ini menggunakan reaktan dan produk reaksi. Saat memberikan ekspresi laju sehubungan dengan reaktan, kita harus menggunakan tanda minus karena, selama reaksi, jumlah reaktan berkurang seiring waktu. Saat menulis ekspresi laju menggunakan produk, plus tanda digunakan karena jumlah produk meningkat seiring waktu.
Selain itu, kita harus mempertimbangkan hubungan stoikiometrik saat memberikan ekspresi laju untuk menyamakan semua ekspresi laju yang diberikan dengan cara apa pun. Misalnya, mari kita pertimbangkan reaksi kimia berikut dan ekspresi laju yang dapat kita berikan untuk itu;
2x +3y ⟶ 5z
Ekspresi laju berikut dimungkinkan untuk reaksi di atas:

Apa itu Tingkat Hukum?
Hukum laju adalah ekspresi matematika dari laju reaksi yang mencakup hubungan antara laju reaktan dan laju produk. Kami dapat menentukan data matematika ini secara eksperimental, dan kami dapat memverifikasi hubungan juga. Ada dua cara utama kita dapat menulis hukum tarif; hukum tingkat diferensial dan hukum tarif terintegrasi.
Hukum tingkat diferensial
Hukum laju diferensial adalah cara mengekspresikan laju reaksi menggunakan perubahan konsentrasi satu atau lebih reaktan. Di sini, kami mempertimbangkan perubahan konsentrasi reaktan selama periode waktu tertentu. Kami menyebutkan interval waktu ini sebagai Δt. Kita dapat menyebutkan perubahan konsentrasi reaktan "r" sebagai Δ [r]. Mari kita pertimbangkan contoh untuk memahami cara menulis hukum tingkat diferensial. Untuk reaksi di mana reaktan "A" terurai untuk memberikan produk dan k adalah konstanta laju sementara n adalah urutan reaksi ini, maka persamaan untuk laju ini adalah sebagai berikut:
- Produk
Hukum tingkat diferensial adalah sebagai berikut:
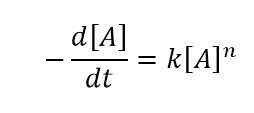
Hukum tingkat terintegrasi
Hukum laju terintegrasi adalah cara mengekspresikan laju reaksi sebagai fungsi waktu. Kita dapat memperoleh ekspresi ini menggunakan hukum tingkat diferensial melalui integrasi hukum tingkat diferensial. Kita juga dapat memperoleh undang -undang tarif terintegrasi ini dari tarif biasa.
Misalnya, untuk reaksi A ⟶ produk, undang -undang laju biasa adalah sebagai berikut:
Rate (r) = k [a]
di mana k adalah konstanta laju dan [a] adalah konsentrasi reaktan a. Jika kita mempertimbangkan interval waktu yang kecil, kita dapat menulis persamaan di atas sebagai berikut:
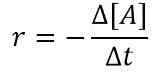
Kami menggunakan tanda minus (-) di sini karena A adalah reaktan dan dengan meningkatnya waktu, konsentrasi penurunan. Maka kita bisa mendapatkan hubungan sebagai berikut dengan menggabungkan dua persamaan di atas;
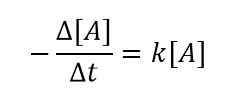
Untuk perubahan yang sangat kecil dalam konsentrasi reaktan pada interval waktu yang sangat kecil, kita dapat menulis persamaan seperti di bawah ini;
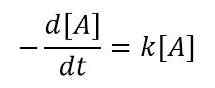
Atau
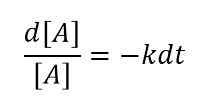
Kemudian, dengan mengintegrasikan persamaan ini, kita dapat memperoleh hubungan berikut:
ln [a] = -kt +konstanta
Oleh karena itu, ketika waktu adalah nol atau t = 0, ln [a] adalah konsentrasi awal reaktan (kita dapat memberikannya sebagai [a]0) karena pada t = 0, -kt = 0 jadi ln [a]0= konstan. Untuk reaksi orde pertama, undang-undang laju terintegrasi adalah,
ln [a] = ln [a]0 - KT
Apa perbedaan antara ekspresi tingkat dan hukum tarif?
Ekspresi laju dan laju AW adalah dua cara untuk memberikan perincian tentang laju reaksi. Perbedaan utama antara ekspresi laju dan hukum laju adalah bahwa ekspresi laju memberikan laju penampilan atau hilangnya produk atau reaktan, sedangkan hukum tingkat memberikan hubungan antara laju dan konsentrasi atau tekanan reaktan.
Di bawah infografis merangkum perbedaan antara ekspresi tingkat dan hukum tarif.
Ringkasan -Hukum Ekspresi Vs Rate
Ekspresi laju dan hukum laju adalah dua cara untuk memberikan perincian tentang laju reaksi. Perbedaan utama antara ekspresi laju dan hukum laju adalah bahwa ekspresi laju memberikan laju penampilan atau hilangnya produk atau reaktan, sedangkan hukum tingkat memberikan hubungan antara laju dan konsentrasi atau tekanan reaktan.
Referensi:
1. “Ekspresi laju dan urutan reaksi." LinkedIn Slideshare, 15 September. 2013, tersedia di sini.


