Perbedaan antara hukum tingkat dan hukum aksi massa
Perbedaan Utama - Tingkat Hukum vs Hukum Aksi Massa
Itu perbedaan utama antara tarif hukum dan hukum tindakan massa adalah itu Hukum laju menunjukkan hubungan antara laju reaksi kimia dan konsentrasi reaktan sedangkan hukum aksi massa menyatakan bahwa laju reaksi kimia sebanding dengan massa zat yang bereaksi.
Hukum tingkat adalah hukum dalam kimia yang digunakan untuk menjelaskan perilaku campuran reaksi. Hukum laju menunjukkan bahwa laju reaksi berbanding lurus dengan laju reaksi. Konstanta proporsionalitas dikenal sebagai konstanta laju. Hukum aksi massa menunjukkan bahwa laju reaksi reaksi kimia berbanding lurus dengan produk massa reaktan yang dinaikkan menjadi kekuatan (seringkali sama dengan koefisien stoikiometrik mereka dalam persamaan kimia) yang ditentukan secara eksperimental.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu Tingkat Hukum
3. Apa Hukum Aksi Massa
4. Perbandingan berdampingan - Hukum tingkat vs hukum aksi massa dalam bentuk tabel
5. Ringkasan
Apa itu Tingkat Hukum?
Hukum laju menunjukkan hubungan antara laju reaksi kimia dan konsentrasi reaktan. Menurut hukum tingkat, laju reaksi berbanding lurus dengan konsentrasi reaktan yang dinaikkan ke suatu kekuatan (seringkali sama dengan hubungan stoikiometri dalam persamaan kimia) yang ditentukan secara eksperimental.
Tingkat hukum dapat ditemukan dalam dua jenis sebagai berikut:
- Hukum tingkat diferensial
Hukum laju diferensial memberikan laju reaksi sebagai fungsi dari perubahan konsentrasi reaktan selama periode waktu tertentu.
- Hukum tingkat terintegrasi
Undang -undang laju terintegrasi memberikan laju reaksi sebagai fungsi dari konsentrasi awal reaktan pada periode waktu tertentu.
Mari kita pertimbangkan contoh untuk memahami ini.
AA +BB → CC +DD
Tingkat = k [a]A[B]B
Persamaan di atas memberikan ekspresi matematika dari hukum tarif. Di sana, "k" adalah konstanta proporsionalitas. Itu dikenal sebagai konstanta laju. Eksponen "A" dan "B" adalah perintah reaksi sehubungan dengan reaktan A dan B masing -masing. Urutan keseluruhan (p) dari reaksi diberikan sebagai jumlah dari semua perintah dalam persamaan hukum tingkat.
p = a + b

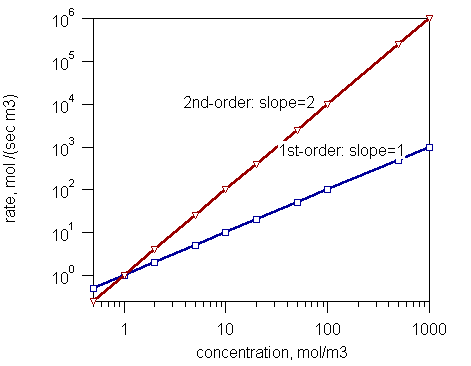
Gambar 1: Laju reaksi dan konsentrasi reaksi orde pertama dan reaksi orde kedua.
Berdasarkan urutan keseluruhan reaksi, reaksi dalam tiga jenis sebagai:
- Reaksi orde nol - laju reaksi tidak tergantung pada konsentrasi reaktan
- Reaksi orde pertama - Laju reaksi sebanding dengan konsentrasi satu reaktan.
- Reaksi orde kedua - Laju reaksi sebanding dengan produk konsentrasi dua reaktan atau ke kuadrat konsentrasi satu reaktan.
Apa Hukum Aksi Massa?
Hukum tindakan massa menunjukkan bahwa laju reaksi kimia sebanding dengan massa zat yang bereaksi. Itu juga dikenal sebagai Hukum tindakan massal. Undang -undang ini berguna untuk mendapatkan persamaan keseimbangan yang akurat dari reaksi kimia tertentu. Hukum juga diberikan oleh kegiatan atau konsentrasi reaktan. Menurut hukum aksi massa, rasio antara konsentrasi produk dan reaktan adalah konstanta dalam campuran reaksi yang berada dalam keadaan kesetimbangan.
Hukum tindakan massa adalah konsep universal, yang berarti, itu berlaku untuk sistem apa pun dalam keadaan apa pun. Undang -undang ini dapat diberikan dalam ekspresi matematika seperti di bawah ini.
Untuk reaksi,
AA +BB ↔ CC +DD
Rasio antara produk dan reaktan pada keseimbangan;
Keq = [c]C[D]D / [A]A[B]B
Pada suhu tertentu, rasio di atas adalah konstan untuk keseimbangan antara reaktan (A dan B) dan produk (C dan D). Di sini, Keq dikenal sebagai konstanta keseimbangan.
Apa perbedaan antara hukum tingkat dan hukum aksi massa?
Tingkat hukum vs hukum aksi massa | |
| Hukum laju menunjukkan bahwa laju reaksi berbanding lurus dengan konsentrasi reaktan yang dinaikkan menjadi kekuatan yang ditentukan secara eksperimental. | Hukum tindakan massa menunjukkan bahwa laju reaksi kimia sebanding dengan massa zat yang bereaksi. |
| Komponen persamaan | |
| Persamaan hukum laju memiliki konstanta laju, konsentrasi reaktan dan urutan reaksi. | Hukum aksi massa memiliki persamaan yang terdiri dari konsentrasi produk dan reaktan yang dinaikkan dengan kekuatan koefisien stoikiometrik mereka. |
| Produk | |
| Persamaan hukum tingkat tidak mengandung konsentrasi produk. | Hukum Persamaan Aksi Massa berisi konsentrasi produk. |
| Komponen proporsionalitas | |
| Konstanta proporsionalitas persamaan hukum tingkat dikenal sebagai konstanta laju “k”. | Tidak ada konstanta proporsionalitas dalam Persamaan Tindakan Massa. |
Ringkasan - Tingkat Hukum vs Hukum Aksi Massa
Tingkat hukum dan hukum tindakan massa digunakan untuk menjelaskan perilaku campuran reaksi. Perbedaan utama antara hukum tingkat dan hukum tindakan massa adalah bahwa hukum tingkat menunjukkan hubungan antara laju reaksi kimia dan konsentrasi reaktan sedangkan hukum tindakan massa menunjukkan bahwa laju reaksi kimia sebanding dengan konsentrasi dari zat yang bereaksi.
Referensi:
1. “Hukum tingkat.”Kimia Libretexts, 21 Juli 2016, tersedia di sini.
2. “12.3 tarif hukum.Kimia, tersedia di sini.
3. Laidler, Keith J. “Hukum Aksi Massa.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 26 Oktober. 2016, tersedia di sini.
Gambar milik:
1. "Rateloglogplot" oleh Fabiuccio ~ enwikibooks di Wikibooks Inggris - ditransfer dari EN.wikibooks ke commons., (Domain publik) via commons wikimedia


