Perbedaan antara garam yang larut dan tidak larut

Itu perbedaan utama Antara garam yang larut dan tidak larut adalah itu Garam larut dapat larut dalam air pada suhu kamar, sedangkan garam yang tidak larut tidak dapat larut dalam air pada suhu kamar.
Garam adalah senyawa apa pun yang terbentuk dari reaksi antara asam dan basa. Oleh karena itu, garam pada dasarnya mengandung anion (berasal dari asam) dan kation (berasal dari basa). Kita dapat membagi senyawa garam menjadi dua jenis tergantung pada kelarutan airnya pada suhu kamar. Mereka adalah garam yang larut dan tidak larut. Kelarutan garam tergantung pada jenis interaksi yang dapat mereka miliki dengan molekul air.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu garam larut
3. Apa garam yang tidak larut
4. Perbandingan berdampingan - garam larut vs tidak larut dalam bentuk tabel
5. Ringkasan
Apa itu garam larut?
Garam terlarut adalah senyawa garam yang larut dalam air pada suhu kamar. Senyawa garam ini larut dalam air karena mereka dapat membentuk atraksi antar molekul dengan molekul air. Molekul air adalah polar. Oleh karena itu, air adalah pelarut kutub, dan garam kutub dapat larut dalam air.

Gambar 01: Sodium klorida adalah garam yang larut
Karena garam adalah senyawa ionik, mereka larut dalam air karena molekul air cenderung menarik ion dalam senyawa, yang membuatnya terpisah satu sama lain, menghasilkan pembubaran garam. Di sini, pembubaran garam membentuk spesies ionik dalam air, yang membuat larutan berair yang baru terbentuk sangat konduktif. Spesies ionik yang dilarutkan dalam air dapat menghantarkan listrik melaluinya. Contoh garam yang larut adalah garam meja atau natrium klorida. Larutan berair garam meja mengandung ion natrium dan ion klorida.
Apa garam yang tidak larut?
Garam yang tidak larut adalah senyawa garam yang tidak larut dalam air pada suhu kamar. Ini tidak larut dalam air karena molekul air tidak dapat menarik ion dalam senyawa garam. Oleh karena itu, tidak ada interaksi antar molekul antara molekul air dan senyawa garam yang tidak larut.

Gambar 02: endapan perak klorida dalam air
Selain itu, garam yang tidak larut adalah senyawa nonpolar. Tidak seperti garam yang larut, pencampuran garam yang tidak larut dengan air tidak membuat larutan konduktif karena garam tidak terpisah menjadi ion. Contoh yang baik dari garam yang tidak larut adalah perak klorida (agcl).
Apa perbedaan antara garam yang larut dan tidak larut?
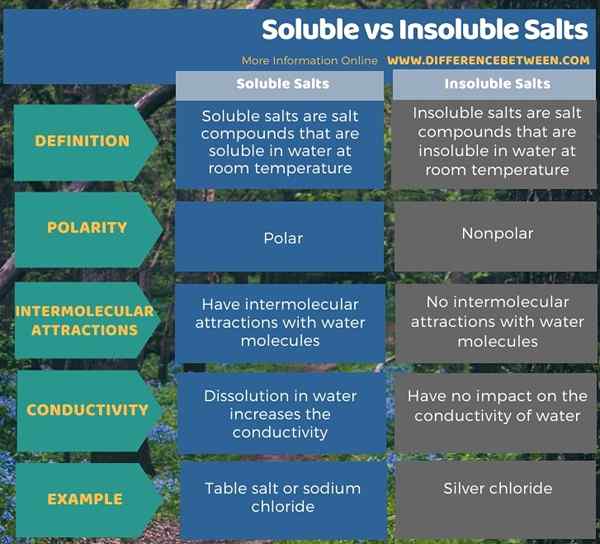
Kita dapat membagi senyawa garam menjadi dua jenis tergantung pada kelarutan airnya. Mereka adalah garam yang larut dan tidak larut. Perbedaan utama antara garam yang larut dan tidak larut adalah bahwa garam yang larut dapat larut dalam air pada suhu kamar, sedangkan garam yang tidak larut tidak dapat larut dalam air pada suhu kamar. Selain itu, garam yang larut adalah kutub; Itu sebabnya mereka bisa larut dalam air, yang merupakan pelarut polar. Sebaliknya, garam yang tidak larut adalah nonpolar. Jadi, ini adalah perbedaan signifikan lainnya antara garam yang larut dan tidak larut.
Selain di atas, molekul air dapat membentuk atraksi antar molekul dengan ion garam yang larut, tetapi tidak ada interaksi antar molekul antara garam yang tidak larut dan air. Selain itu, pembubaran garam yang larut dalam air membuat larutan berair yang sangat konduktif karena ion yang dilarutkan dalam air dapat menghantarkan listrik melaluinya. Tidak seperti garam yang larut, mencampur garam yang tidak larut dengan air tidak membuat air konduktif. Sodium klorida adalah contoh garam larut, sedangkan perak klorida adalah contoh untuk garam yang tidak larut.
Ringkasan -garam yang larut dan tidak larut
Kita dapat membagi senyawa garam menjadi dua jenis tergantung pada kelarutan airnya. Mereka adalah garam yang larut dan tidak larut. Perbedaan utama antara garam yang larut dan tidak larut adalah bahwa garam yang larut dapat larut dalam air pada suhu kamar, sedangkan garam yang tidak larut tidak dapat larut dalam air pada suhu kamar. Selain itu, garam yang larut adalah kutub; Itu sebabnya mereka bisa larut dalam air, yang merupakan pelarut polar. Sebaliknya, garam yang tidak larut adalah nonpolar.
Referensi:
1. “Garam yang tidak larut.”Kimia Libretexts, Libretexts, 5 Juni 2019, tersedia di sini.
2. “Definisi garam yang tidak larut (endapan).Kamus Cehmicool, tersedia di sini.
3. “Garam yang tidak larut.”Garam-tripod, tersedia di sini.
Gambar milik:
1. “Sodium Chloride” oleh ChemicalInterest - Pekerjaan Sendiri (Domain Publik) Via Commons Wikimedia
2. “Silver Chloride (AgCl)” oleh Luisbrudna - Karya Sendiri (CC BY -SA 4.0) Via Commons Wikimedia


