Perbedaan antara sulfon dan sulfoksida
Itu perbedaan utama antara sulfon dan sulfoksida adalah itu Senyawa sulfon memiliki dua atom oksigen terikat ganda, sedangkan sulfoksida hanya memiliki satu atom oksigen terikat ganda.
Sulfon dan sulfoksida adalah senyawa organik. Kedua senyawa ini mengandung atom sulfur sentral yang terikat pada atom oksigen dan kelompok organik alkil atau aril aril. Sulfon adalah senyawa organik yang mengandung gugus fungsi sulfonil yang melekat pada dua atom karbon sedangkan sulfoksida adalah senyawa organik yang mengandung atom belerang sentral yang melekat pada dua atom karbon dan atom oksigen.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu Sulfone
3. Apa itu sulfoksida
4. Kesamaan antara sulfon dan sulfoksida
5. Perbandingan berdampingan - sulfon vs sulfoksida dalam bentuk tabel
6. Ringkasan
Apa itu Sulfone?
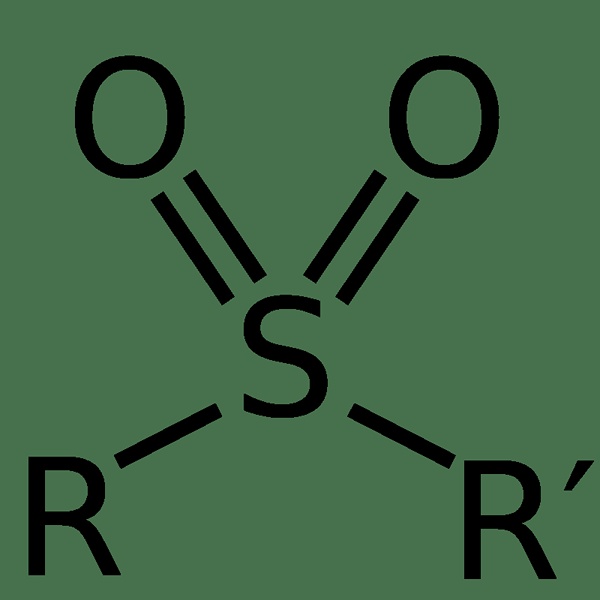
Sulfon adalah senyawa organik yang mengandung gugus fungsional sulfonil yang melekat pada dua atom karbon. Oleh karena itu, atom belerang berada di tengah senyawa, dan itu menunjukkan heksavalensi. Atom belerang ini memiliki dua atom oksigen berikat ganda yang melekat padanya. Keadaan oksidasi atom belerang ini adalah +6. Biasanya, dua atom karbon yang melekat pada atom sulfur tengah berada dalam dua substituen hidrokarbon terpisah.

Gambar 01: Struktur kimia molekul sulfon
Ada beberapa metode berbeda untuk menghasilkan senyawa sulfon. Metode yang paling umum adalah oksidasi thioester dan sulfoksida. E.G. oksidasi dimethyl sulfide membentuk dimethyl sulfoxide diikuti oleh konversi menjadi dimetil sulfon. Selanjutnya, kita dapat menghasilkan senyawa sulfon dari SO2, yang merupakan sumber gugus fungsional sulfonil yang nyaman dan banyak digunakan. Selain itu, kita dapat menghasilkan sulfon dari sulfonil dan sulfuryl halida juga.
Ada berbagai aplikasi sulfon. Penting untuk mengekstraksi senyawa aromatik yang berharga dari minyak bumi, dalam pembuatan bahan polimer, dalam farmakologi, dll.
Apa itu sulfoksida?
Sulfoksida adalah senyawa organik yang mengandung atom sulfur sentral yang melekat pada dua atom karbon dan atom oksigen. Ini mengandung gugus fungsional sulfinil, yang merupakan gugus kutub (atom oksigen memiliki muatan negatif parsial sedangkan atom belerang memiliki muatan positif partikel). Senyawa ini adalah turunan dari sulfida yang terbentuk dari oksidasi.
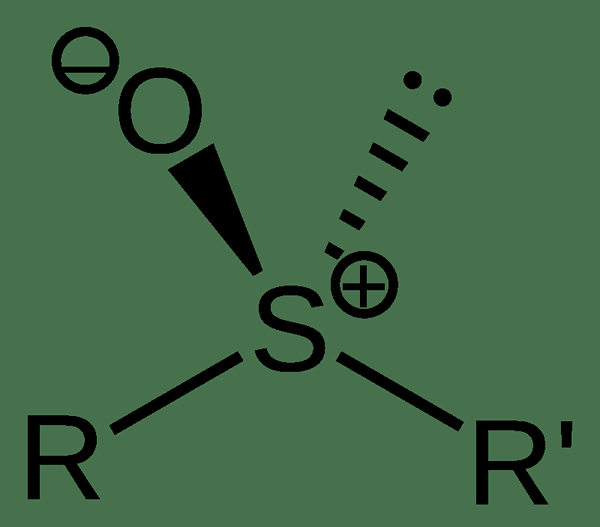
Gambar 02: Struktur kimia sulfoksida
Biasanya, sulfoksida terbentuk dari oksidasi sulfida dengan adanya oksidan seperti hidrogen peroksida. Namun, kita perlu dengan hati -hati menangani campuran reaksi oksidasi ini karena ini bisa menjadi reaksi yang agresif. Selain itu, kita dapat menghasilkan sulfoksida dari sulfur dioksida melalui reaksi arilasi kerajinan friedel.
Ada beberapa aplikasi penting sulfoksida - menggunakan sebagai pelarut, digunakan dalam produksi beberapa obat seperti esomeprazole, sebagai katalis, dll.
Apa kesamaan antara sulfon dan sulfoksida?
- Sulfon dan sulfoksida adalah senyawa organik.
- Senyawa ini mengandung atom belerang sentral.
- Kedua senyawa ini mengandung ikatan S = O.
Apa perbedaan antara sulfon dan sulfoksida?
Sulfon dan sulfoksida adalah senyawa organik yang mengandung atom belerang. Sulfon adalah senyawa organik yang mengandung gugus fungsi sulfonil yang melekat pada dua atom karbon sedangkan sulfoksida adalah senyawa organik yang mengandung atom belerang sentral yang melekat pada dua atom karbon dan atom oksigen. Perbedaan utama antara sulfon dan sulfoksida adalah bahwa senyawa sulfon memiliki dua atom oksigen terikat ganda, sedangkan sulfoksida hanya memiliki satu atom oksigen terikat ganda.
Infografis berikut merangkum perbedaan antara sulfon dan sulfoksida dalam bentuk tabel untuk perbandingan berdampingan.
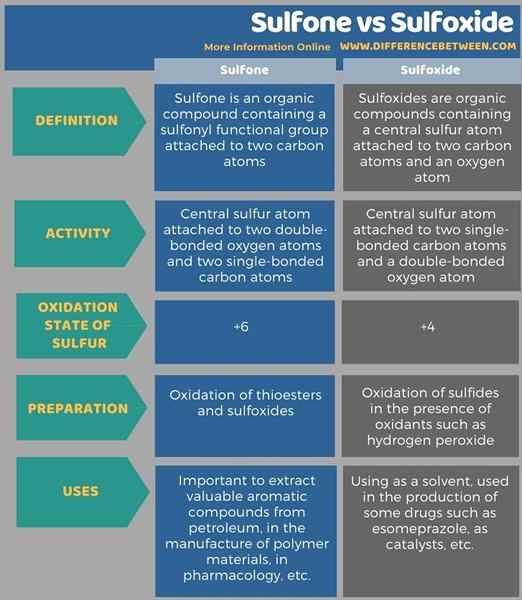
Ringkasan -Sulfon vs Sulfoksida
Sulfon adalah senyawa organik yang mengandung gugus fungsional sulfonil yang melekat pada dua atom karbon. Sulfoksida adalah senyawa organik yang mengandung atom sulfur sentral yang melekat pada dua atom karbon dan atom oksigen. Perbedaan utama antara sulfon dan sulfoksida adalah bahwa senyawa sulfon memiliki dua atom oksigen terikat ganda sedangkan sulfoksida hanya memiliki satu atom oksigen terikat ganda.
Referensi:
1. “Sulfoksida." Sulfoxide - Topik ScienceDirect, Tersedia disini.
Gambar milik:
1. "Sulfone" oleh Sulfone.PNG: Benjah -BMM27 Pekerjaan Diri: Vladsinger (Talk) - Sulfone.PNG (domain publik) melalui Commons Wikimedia
2. “Sulfoxide -Tetrahedral” oleh Nothingserious - Karya Sendiri (Domain Publik) Via Commons Wikimedia


