Perbedaan antara titrasi dan netralisasi

Itu perbedaan utama antara titrasi dan netralisasi adalah itu Titrasi adalah teknik analitik, sedangkan netralisasi adalah reaksi kimia.
Titrasi dan netralisasi adalah istilah yang sangat penting dalam kimia. Titrasi adalah teknik yang membutuhkan peralatan tertentu, dan hasilnya berdasarkan reaksi netralisasi. Reaksi netralisasi adalah reaksi kimia di mana keasamannya seimbang dengan penambahan basis atau sebaliknya untuk mendapatkan larutan netral.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu titrasi
3. Apa itu netralisasi
4. Perbandingan berdampingan -titrasi vs netralisasi dalam bentuk tabel
5. Ringkasan
Apa itu titrasi?
Titrasi adalah teknik analitik yang berguna dalam mengukur konsentrasi larutan kimia tertentu. Kita dapat melakukan ini menggunakan solusi yang memiliki konsentrasi yang diketahui. Proses titrasi membutuhkan peralatan tertentu.
Dalam alat titrasi, ada buret yang biasanya berisi solusi standar dengan konsentrasi yang diketahui. Jika solusi dalam burette bukan solusi standar, itu harus distandarisasi menggunakan standar primer. Labu titrasi diisi dengan konstasi sampel komponen kimia dengan konsentrasi yang tidak diketahui. Jika solusi standar (dalam burette) tidak dapat bertindak sebagai indikator diri, kita harus menambahkan indikator yang sesuai ke sampel dalam labu titrasi.
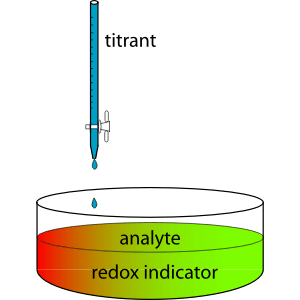
Gambar 01: Reaksi titrasi
Selama proses titrasi, solusi standar ditambahkan ke labu perlahan sampai perubahan warna terjadi. Perubahan warna solusi analit menunjukkan titik akhir titrasi. Meskipun bukan titik yang tepat di mana titrasi berakhir, kita dapat mengasumsikan bahwa itu adalah titik kesetaraan karena hanya ada sedikit perbedaan (titik kesetaraan adalah titik di mana reaksi benar -benar berhenti).
Pembacaan burette berguna untuk menentukan jumlah solusi standar yang bereaksi dengan sampel. Kemudian dengan menggunakan reaksi kimia dan hubungan stoikiometri, kita dapat menghitung konsentrasi yang tidak diketahui.
Apa itu netralisasi?
Istilah netralisasi mengacu pada reaksi kimia antara asam dan basa, yang menghasilkan larutan netral. PH larutan netral adalah pH = 7. Reaksi netralisasi melibatkan kombinasi h+ ion dan oh- ion untuk membentuk molekul air.

Gambar 02: Netralisasi natrium hidroksida dan asam hidroklorat
Jika pH akhir dari campuran reaksi asam dan basa adalah 7, itu berarti jumlah yang sama dari H+ dan oh- ion telah bereaksi dalam reaksi ini (untuk membentuk molekul air satu h+ ion bereaksi dengan satu oh- ion). Asam dan basa yang bereaksi bisa kuat atau lemah. Bergantung pada sifat asam dan basa, ada beberapa jenis reaksi netralisasi sebagai berikut:
- Reaksi basa asam kuat yang kuat
- Reaksi basa asam yang kuat
- Reaksi basa-asam lemah
- Reaksi basa asam yang lemah
Di antara keempat jenis ini, hanya reaksi antara asam kuat dan basa kuat yang memberikan larutan yang dinetralkan dengan tepat pH = 7. Reaksi lain memberikan larutan yang dinetralkan dengan berbagai nilai pH karena variasi pH asam/basa.
Apa perbedaan antara titrasi dan netralisasi?
Titrasi dan netralisasi adalah istilah yang sangat penting dalam kimia. Titrasi adalah teknik yang membutuhkan peralatan tertentu, dan hasilnya berdasarkan reaksi netralisasi. Perbedaan utama antara titrasi dan netralisasi adalah bahwa titrasi adalah teknik analitik, sedangkan netralisasi adalah reaksi kimia.
Di bawah infografis membandingkan perbedaan antara titrasi dan netralisasi dalam bentuk tabel.
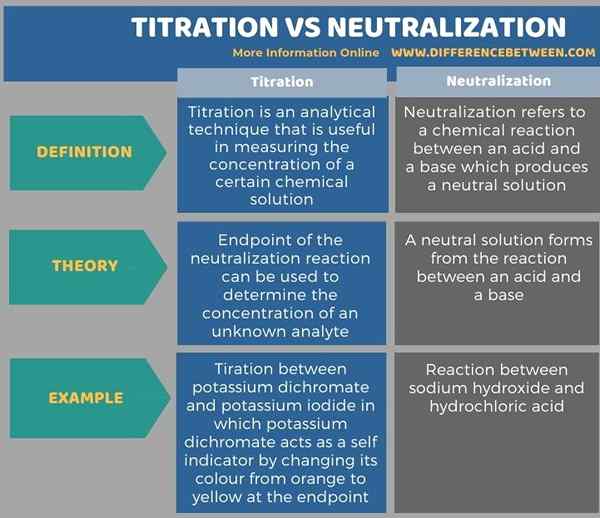
Ringkasan -Titrasi vs Netralisasi
Titrasi dan netralisasi adalah istilah yang sangat penting dalam kimia. Titrasi adalah teknik yang membutuhkan peralatan tertentu, dan hasilnya berdasarkan reaksi netralisasi. Perbedaan utama antara titrasi dan netralisasi adalah bahwa titrasi adalah teknik analitik, sedangkan netralisasi adalah reaksi kimia.
Referensi:
1. “Titrasi.”Kimia Libretexts, Libretexts, 23 Juni 2019, tersedia di sini.
Gambar milik:
1. “Titrasi Redoks Menggunakan Indikator” (CC0) melalui SVG gratis
2. “Reaksi netralisasi antara natrium hidroksida dan asam hidroklorat” oleh Bluescan SV.Wiki - Pekerjaan Sendiri (CC BY -SA 3.0) Via Commons Wikimedia