Perbedaan antara konstanta gas konstan gas universal dan konstanta gas yang khas
Perbedaan utama - konstanta gas konstan gas universal vs konstanta gas karakteristik
Fase gas adalah salah satu dari tiga fase utama materi bisa ada. Ini adalah keadaan yang paling kompresibel dari tiga keadaan materi. Hanya 11 elemen dari elemen lain yang ada sebagai gas dalam kondisi normal. Namun, "hukum gas ideal" memberi kita persamaan yang dapat digunakan untuk menjelaskan perilaku gas normal. Ini memiliki konstanta proporsionalitas yang disebut konstan gas universal dan ketika diterapkan pada gas asli, konstanta ini digunakan dengan modifikasi. Maka itu disebut konstanta gas karakteristik. Perbedaan utama antara konstanta gas universal dan konstanta gas yang khas adalah bahwa Konstanta gas universal hanya berlaku untuk gas ideal sedangkan Konstanta gas karakteristik berlaku untuk gas nyata.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu konstanta gas universal
3. Apa itu Konstanta Gas Karakteristik
4. Perbandingan Berdampingan - Konstanta Gas Universal Vs Konstanta Gas Karakteristik Dalam Bentuk Tabel
5. Ringkasan
Apa itu konstanta gas universal?
Molekul gas mampu bergerak bebas di seluruh ruang karena mereka adalah molekul yang sangat ringan. Gaya antara molekul gas lemah gaya tarik van der waal. Namun, untuk menjelaskan perilaku gas, para ilmuwan telah memperoleh teori menggunakan gas hipotetis yang dikenal sebagai gas ideal. Mereka juga telah memperoleh undang -undang tentang gas ideal ini, yang dikenal sebagai hukum gas ideal.
Pertama, kita harus tahu apa arti gas yang ideal. Ini adalah gas hipotetis yang akan menunjukkan sifat -sifat berikut jika itu adalah gas asli. Ini hanya asumsi.
- Gas ideal terdiri dari sejumlah besar molekul gas kecil.
- Volume molekul gas tersebut dapat diabaikan.
- Tidak ada atraksi antara molekul gas.
- Gerakan molekul gas ini mematuhi hukum gerak Newton.
- Tabrakan molekul benar -benar elastis.
Dengan melihat sifat -sifat ini, dapat dimengerti bahwa tidak ada gas asli yang ideal.
Apa itu Hukum Gas Ideal
Undang -undang Gas Ideal menunjukkan keadaan gas ideal dan dijelaskan oleh persamaan sebagai berikut.
PV = NRT
P - Tekanan gas ideal
V - Volume Gas Ideal
n - Jumlah mol dari gas ideal (jumlah zat)
T - suhu
Istilah r di sini adalah konstanta gas universal. Nilai R dapat dihitung dengan mempertimbangkan suhu dan tekanan standar yaitu 00Tekanan C dan 1Atm. Ini memberikan nilai untuk konstanta gas universal sebagai 0.082057 L/(k.mol).
Apa itu Konstanta Gas Karakteristik?
Saat menerapkan persamaan gas ideal untuk gas normal, persamaan di atas memerlukan modifikasi karena tidak ada gas asli yang berperilaku sebagai gas yang ideal. Dengan demikian, konstanta gas karakteristik, bukan konstanta gas universal, digunakan di sana. Sifat -sifat gas nyata yang berbeda dari gas ideal dapat terdaftar seperti di bawah ini.
- Gas asli terdiri dari molekul besar yang dapat dibedakan dibandingkan dengan gas ideal.
- Molekul gas ini memiliki volume tertentu.
- Ada gaya van der waal yang lemah antara molekul gas.
- Tabrakan tidak sepenuhnya elastis.
Oleh karena itu, hukum gas ideal tidak dapat diterapkan langsung ke gas asli. Dengan demikian, modifikasi sederhana dilakukan; Konstanta gas universal dibagi dengan massa molar gas sebelum menerapkannya dalam persamaan. Itu bisa ditampilkan sebagai berikut.
Rspesifik = R/m
Rspesifik - Konstanta Gas Karakteristik
R - konstanta gas universal
M- massa gas molar
Ini dapat digunakan bahkan untuk campuran gas. Kemudian, konstanta r harus dibagi dengan massa molar campuran gas. Konstanta gas karakteristik ini juga dikenal sebagai spesifik konstanta gas Karena nilainya tergantung pada gas atau campuran gas.

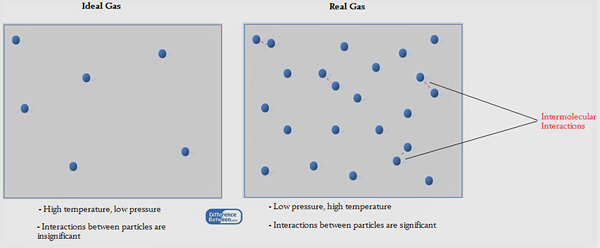
Gambar 01: Gas Ideal vs Gas Nyata
Apa perbedaan antara konstanta gas konstan gas universal dan konstanta gas yang khas?
Konstanta gas konstan vs gas universal konstan gas karakteristik | |
| Konstanta gas universal hanya diterapkan untuk gas yang ideal. | Konstanta gas karakteristik diterapkan untuk gas asli. |
| Perhitungan | |
| Konstanta gas universal dihitung menggunakan nilai suhu dan tekanan standar (STP). | Konstanta gas karakteristik dihitung dengan nilai STP bersama dengan massa molar gas asli. |
| Hubungan dengan gas | |
| Konstanta gas universal tidak tergantung pada gas yang diambil. | Konstanta gas karakteristik tergantung pada gas. |
| Nilai | |
| Nilai konstanta gas universal adalah 0.082057 L/(k.mol). | Nilai untuk konstanta gas karakteristik akan selalu tergantung pada gas. |
Ringkasan -Konstanta Gas Konstanta Gas Universal Vs Konstanta Gas Karakteristik
Gas ideal adalah gas hipotetis yang diasumsikan memiliki sifat yang sangat berbeda dari gas asli. Hukum gas ideal dibentuk untuk menjelaskan perilaku gas ideal. Namun, dalam menggunakan konstanta ini pada gas nyata, itu harus dimodifikasi dengan menerapkan konstanta gas karakteristik selain konstanta gas universal. Itu karena tidak ada gas asli yang berperilaku sebagai gas yang ideal. Perbedaan utama antara konstanta gas universal dan konstanta gas karakteristik adalah bahwa konstanta gas universal hanya berlaku untuk gas ideal sedangkan konstanta gas karakteristik berlaku untuk gas nyata.
Unduh Konstanta Gas Konstanta Gas Universal Vs Konstanta Karakteristik
Anda dapat mengunduh versi PDF artikel ini dan menggunakannya untuk tujuan offline sesuai catatan kutipan. Silakan unduh versi PDF di sini perbedaan antara konstanta gas universal dan konstanta gas yang khas.


