Perbedaan antara asam lemah dan kuat
Itu perbedaan utama Antara asam lemah dan kuat adalah itu Asam lemah terionisasi sebagian dalam air sedangkan asam kuat terionisasi sepenuhnya.
Kekuatan asam adalah kemampuannya untuk mengionisasi atau menyumbangkan ion hidrogen dalam larutan berair yang bereaksi dengan air. Semakin asam terionisasi, semakin kuat, dan semakin sedikit produksi ion hidrogen menunjukkan asam lemah. Inilah perbedaan antara asam yang kuat dan lemah. Konsentrasi ion dalam larutan berair asam memberi tahu seberapa kuat atau lemah asam itu. Jadi, Anda dapat memiliki larutan asam terkonsentrasi dari asam lemah, dan sangat mungkin untuk memiliki larutan encer asam yang kuat.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu asam lemah
3. Apa itu Asam Kuat
4. Perbandingan berdampingan - asam lemah vs kuat dalam bentuk tabel
5. Ringkasan
Apa itu asam lemah?
Asam lemah mengacu pada senyawa kimia yang sebagian terdisosiasi menjadi ion dalam larutan berair. Mereka tidak melepaskan jumlah total ion hidrogen yang dapat dilepas (h+) ke dalam solusi. Untuk asam ini, konstanta disosiasi asam atau kA adalah nilai kecil. PH solusi ini terletak sekitar 3 hingga 5. Terutama, ini karena asam lemah ini tidak dapat meningkatkan kandungan ion hidrogen dalam larutan sebanyak asam yang kuat.

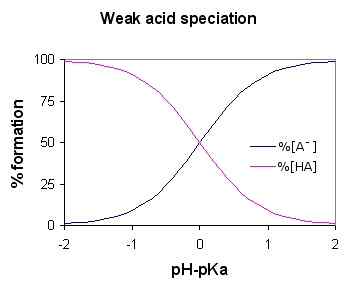
Gambar 01: Diagram spesiasi asam lemah (untuk asam lemah HA)
Karena asam lemah terdisosiasi sebagian, larutan berair mengandung tiga komponen utama; ion hidrogen, molekul asam berserikat dan basa terkonjugasi (anion terikat dengan ion hidrogen dalam molekul asam). Beberapa contoh umum termasuk asam belerang, asam fosfat, asam nitro, dll.
Apa itu Asam Kuat?
Asam kuat mengacu pada molekul yang sepenuhnya terpisah menjadi ion dalam larutan berair. Oleh karena itu, senyawa ini sepenuhnya terionisasi dalam air. Nilai konstanta disosiasi asam atau Ka adalah nilai tinggi untuk jenis asam ini. Lebih kuat asam, lebih mudah pelepasan ion hidrogen. Terutama, ini terjadi karena polaritas yang tinggi dari ikatan H-A di mana H adalah atom hidrogen, dan A adalah basis konjugat. Agar sangat polar, perbedaan elektronegativitas antara atom di setiap sisi ikatan ini harus tinggi.
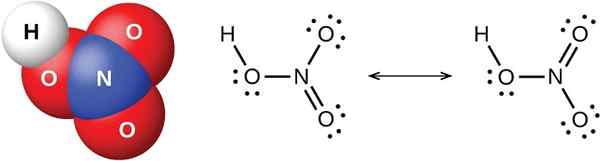
Gambar 02: Struktur kimia asam kuat HNO3 (asam nitrat)
Selain itu, pelepasan ion hidrogen ini juga tergantung pada ukuran anion (basis terkonjugasi) yang melekat pada ion hidrogen. Jika anion besar dan lebih stabil, maka dapat dengan mudah melepaskan ion hidrogen. Tidak seperti asam lemah, asam kuat ini melepaskan semua ion hidrogen yang mungkin ke larutan berair. Nilai pH dari larutan berair ini sangat kecil; dapat berkisar dari 1 hingga 3.
Apa perbedaan antara asam lemah dan kuat?
Asam lemah terionisasi sebagian dalam air sedangkan asam kuat terionisasi sepenuhnya. Oleh karena itu, ionisasi adalah perbedaan utama antara asam lemah dan kuat. Selain itu, satu perbedaan lain antara asam lemah dan kuat adalah bahwa asam lemah tidak menghilangkan semua atom hidrogen yang dapat dilepas. Sebaliknya, asam yang kuat melepaskan semua atom hidrogen yang mungkin.
Selain itu, ada perbedaan antara asam lemah dan kuat berdasarkan nilai pH mereka juga. Itu adalah; Nilai pH asam lemah berkisar dari 3 hingga 5 sedangkan asam kuat berkisar dari 1 hingga 3. Juga, konstanta disosiasi asam berkontribusi pada perbedaan lain antara asam lemah dan kuat. Disosiasi asam konstan asam lemah kecil dibandingkan dengan asam kuat.
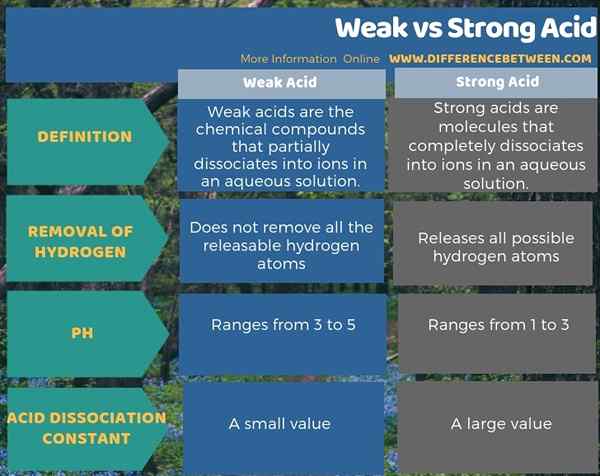
Ringkasan -asam lemah vs kuat
Asam adalah molekul yang dapat melepaskan ion hidrogen ke larutan berair. Kita dapat mengklasifikasikan semua asam sebagai asam kuat, asam yang cukup kuat dan asam lemah. Singkatnya, perbedaan utama antara asam lemah dan kuat adalah bahwa asam lemah terionisasi sebagian dalam air sedangkan asam kuat terionisasi sepenuhnya.
Referensi:
1. Helmenstine, Anne Marie, PH.D. “Daftar asam kuat dan lemah."Thoughtco, SEP. 24, 2018. Tersedia disini
2. Helmenstine, Anne Marie, PH.D. “Definisi asam lemah dan contoh dalam kimia."Thoughtco, Jun. 18, 2018. Tersedia disini
Gambar milik:
1."Spesiasi Asam Lemah" oleh P. Gans dan ditransfer dengan leaw., (Domain publik) via commons wikimedia
2."CNX Chem 18 09 HNO3" oleh OpenStax (CC oleh 4.0) Via Commons Wikimedia


