Apa perbedaan antara aspartil sistein dan protease serin
Itu perbedaan utama Antara aspartil sistein dan protease serin adalah kelompok fungsional mereka yang bertindak sebagai residu katalitik. The functional group that acts as the catalytic residues of aspartyl protease is a carboxylic acid group, while in cysteine protease, a thiol or sulfhydryl group acts as the functional group at the catalytic residue, and in serine protease, a hydroxyl group or an alcohol acts sebagai kelompok fungsional pada residu katalitik.
Protease adalah enzim yang mengkatalisasi proteolisis, yang merupakan pemecahan protein menjadi polipeptida yang lebih kecil atau asam amino. Proses ini terjadi dengan membelah ikatan peptida dalam protein dengan proses hidrolisis. Protease terlibat dalam banyak fungsi biologis, seperti pencernaan protein yang tertelan, katabolisme protein, dan pensinyalan sel. Protease hadir dalam segala bentuk kehidupan. Aspartil, sistein, dan serin adalah tiga protease penting yang memainkan peran kunci dalam organisme hidup.
ISI
1. Ikhtisar dan Perbedaan Utama
2. Apa itu Aspartyl Protease
3. Apa itu protease sistein
4. Apa itu protease serin
5. Kesamaan - Aspartil sistein dan protease serin
6. Aspartyl vs sistein vs protease serin dalam bentuk tabel
7. Ringkasan -aspartil vs sistein vs protease serin
Apa itu Aspartyl Protease?
Aspartyl protease adalah jenis enzim pemecah protein. Mereka memiliki dua aspartat yang sangat dilestarikan di situs aktif, dan mereka secara optimal aktif pada pH asam. Protease ini membelah ikatan dipeptida yang memiliki residu hidrofobik serta gugus beta-metilen. Mekanisme katalitik aspartil protease adalah mekanisme asam-basa. Ini melibatkan koordinasi molekul air dengan dua residu aspartat. Satu aspartat mengaktifkan molekul air dengan menghilangkan proton. Ini memungkinkan air untuk melakukan serangan nukleofilik pada karbon karbonil dari substrat. Akibatnya, ini menghasilkan perantara oksyanion tetrahedral yang distabilkan oleh ikatan hidrogen dengan residu aspartat kedua. Penataan ulang perantara ini bertanggung jawab atas pemisahan peptida menjadi dua produk peptida.
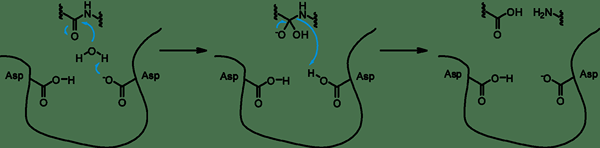
Gambar 01: Aspartyl Protease
Ada lima superfamili dari protease aspartik: klan AA yang merupakan keluarga, klan AC, yang merupakan keluarga sinyal peptidase II, klan AD, yang merupakan keluarga presenilin, klan AE, yang merupakan keluarga endopeptidase GPR, dan klan AF, yang, yang, yang, yang merupakan keluarga endopeptidase GPR, dan Clan, adalah keluarga Omptin.
Apa itu protease sistein?
Protease sistein adalah kelompok enzim hidrolase yang menurunkan protein. Mereka menunjukkan mekanisme katalitik yang melibatkan tiol sistein nukleofilik dalam triad katalitik atau diad. Langkah awal dalam mekanisme katalitik protease sistein adalah deprotonasi. Kelompok tiol menjadi terdeprotonasi di dalam situs aktif enzim oleh asam amino yang berdekatan seperti histidin, yang memiliki rantai samping dasar. Langkah selanjutnya adalah serangan nukleofilik oleh sulfur sistein anionik yang terdeprotonasi pada substrat. Di sini, fragmen substrat melepaskan dengan amina, dan residu histidin dalam protease mengembalikan bentuknya yang terdeprotonasi. Ini menghasilkan pembentukan perantara thioester dari substrat, menghubungkan terminal karboksi baru dengan sistein tiol. Ikatan thioester menghidrolisis untuk menghasilkan bagian asam karboksilat pada fragmen substrat yang tersisa.
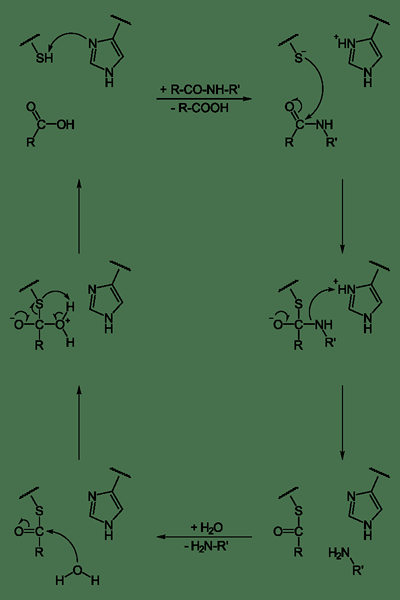
Gambar 02: sistein protease
Protease sistein memainkan banyak peran dalam fisiologi dan pengembangan. Pada tanaman, mereka memainkan peran penting dalam pertumbuhan, perkembangan, akumulasi, dan mobilisasi protein penyimpanan. Pada manusia, mereka penting dalam penuaan dan apoptosis, respons imun, pemrosesan prohormon, dan remodeling matriks ekstraseluler terhadap perkembangan kerucut.
Apa itu protease serin?
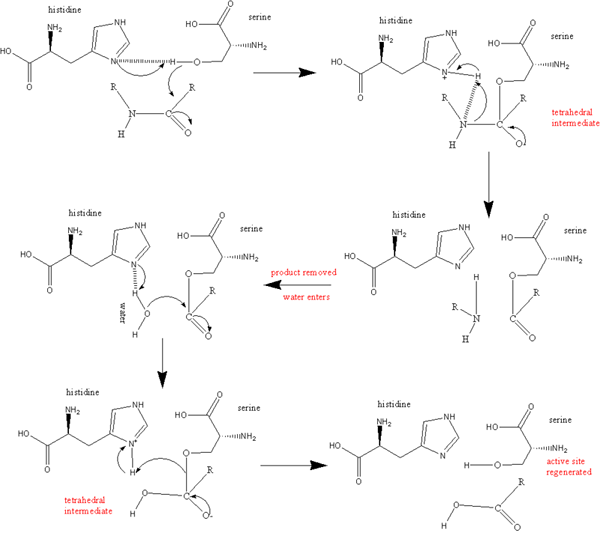
Protease serin juga merupakan kelompok enzim proteolitik yang membelah ikatan peptida dalam protein. Serin berfungsi sebagai asam amino nukleofilik di situs aktif enzim. Ini ada di kedua eukariota dan prokariota. Protease serin biasanya dibagi menjadi berbagai kategori dengan struktur khas yang terdiri dari dua domain beta-barrel yang berkumpul di situs katalitik aktif dan juga berdasarkan spesifisitas substratnya. Mereka seperti trypsin, seperti chymotrypsin, seperti trombin, seperti elastase, dan seperti subtilisin.

Gambar 03: Serine Protease
Protease seperti trypsin membelah ikatan peptida mengikuti asam amino bermuatan positif seperti lisin atau arginin. Mereka spesifik untuk residu bermuatan negatif seperti asam aspartat atau asam glutamat. Protease seperti chymotrypsin lebih hidrofobik. Spesifisitasnya terletak pada residu hidrofobik besar seperti tirosin, triptofan, dan fenilalanin. Protease seperti trombin termasuk trombin, yang merupakan jaringan yang mengaktifkan plasminogen, dan plasmin. Ini membantu dalam koagulasi darah dan pencernaan dan juga dalam patofisiologi pada gangguan neurodegeneratif. Protease seperti elastase lebih suka residu seperti alanin, glisin, dan valine. Protease seperti subtilisin termasuk serin dalam prokariota. Ini berbagi mekanisme katalitik yang menggunakan triad katalitik untuk menciptakan serin nukleofilik. Regulasi aktivitas protease serin membutuhkan aktivasi protease awal dan sekresi inhibitor.
Apa kesamaan antara aspartil sistein dan protease serin?
- Aspartyl, sistein, dan protease serin mengkatalisasi pemecahan protein dengan pembelahan ikatan peptida.
- Mekanisme serupa di mana residu situs aktif menyerang ikatan peptida yang menyebabkannya rusak.
- Semua mengandung nukleofil.
- Mereka semua adalah protein.
Apa perbedaan antara aspartil sistein dan protease serin?
Perbedaan utama antara sistein aspartil dan protease serin tergantung pada kelompok fungsionalnya, yang bertindak sebagai residu katalitik. Dalam aspartyl protease, gugus asam karboksilat bertindak sebagai gugus fungsional, sedangkan dalam sistein protease, kelompok tiol atau sulfhidril bertindak sebagai kelompok fungsional, dan dalam protease serin, gugus hidroksil atau alkohol bertindak sebagai kelompok fungsionalnya.
Aspartyl protease memiliki situs aktif aspartat, sedangkan sistein protease memiliki situs aktif sistein. Residu situs aktif serine protease adalah kelompok hidroksil. Dengan demikian, ini juga perbedaan lain antara aspartil sistein dan protease serin. Tidak seperti protease serin dan sistein, aspartil protease tidak membentuk perantara kovalen selama proses pembelahan. Oleh karena itu, proteolisis terjadi dalam satu langkah untuk aspartil protease.
Infografis di bawah ini menyajikan perbedaan antara aspartil sistein dan protease serin dalam bentuk tabel untuk perbandingan berdampingan.
Ringkasan -Aspartyl Cysteine vs Serine Proteasees
Protease adalah enzim yang mengkatalisasi pemecahan protein menjadi polipeptida yang lebih kecil atau asam amino. Perbedaan utama antara aspartil sistein dan protease serin adalah kelompok fungsional yang bertindak sebagai residu katalitik mereka. Kelompok asam karboksilat bertindak sebagai gugus fungsional dalam aspartil protease, sedangkan kelompok tiol atau sulfhidril bertindak sebagai kelompok fungsional dalam sistein protease. Gugus hidroksil atau alkohol bertindak sebagai kelompok fungsional dalam protease serin.
Referensi:
1. “Mekanisme Protease.”Scitable, Nature News, Nature Publishing Group.
2. “Sistein protease.“Sains Direct.
3. “Serine Protease.“Sains Direct.
Gambar milik:
1. “Aspartyl Protease Mechasism” oleh pengguna Inggris Wikipedia Roadnottaken (CC BY-SA 3.0) Via Commons Wikimedia
2. “CysteinProtease ReaktionsMechanismus” oleh NeuroTiker - karya sendiri (domain publik) melalui Commons Wikimedia
3. "Mekanisme Protease Serine oleh Snellios" oleh Snellios di Wikipedia berbahasa Inggris (CC BY-SA 3.0) Via Commons Wikimedia


